1 . 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________ 0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________ (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
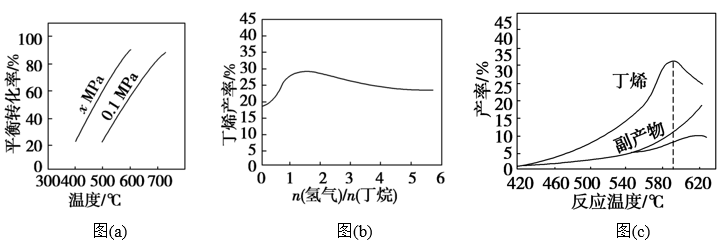
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________ 。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是___________ 、____________ ;590℃之后,丁烯产率快速降低的主要原因可能是_____________ 。
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+
 O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1③H2(g)+
 O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1反应①的ΔH1为
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是
您最近一年使用:0次
2017-08-08更新
|
11799次组卷
|
28卷引用:北京市中国人民大学附属中学2020届高三教学质量监测理科综合化学试题
北京市中国人民大学附属中学2020届高三教学质量监测理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)安徽省淮北市濉溪中学等三校2017-2018学年高二上学期期中联考化学试题(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北衡水中学2020届高三下学期三月份教学质量监测理科综合化学试题湖北省武汉市华中师范大学第一附属中学2020届高三2月份网络教学质量监测理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分安徽省马鞍山市2020届高考第二次模拟理综化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题陕西省西安市西北工业大学附属中学2020届高三教学质量监测理科综合化学试题广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题山东省潍坊市临朐县实验中学2020-2021学年高二9月月考化学试题(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测陕西省子洲中学2019-2020学年高二下学期第一次月考化学试题福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题山东省东营市胜利第二中学2020-2021学年高二10月月考化学试题(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题(已下线)第28讲化化学平衡的移动及反应进行的方向
2 . TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________ 。
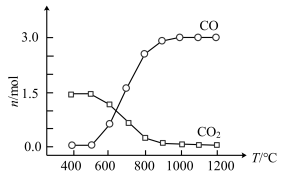
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____ 0(填“>”“<”或“=”),判断依据:_______________ 。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________ 。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________ 。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
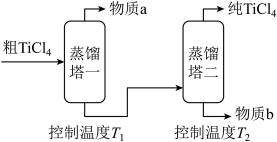
物质a是______________ ,T2应控制在_________ 。

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH

③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:

物质a是
您最近一年使用:0次
2017-08-08更新
|
4034次组卷
|
9卷引用:北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题
北京理工大学附属中学2022-2023学年高三上学期12月月考化学试题(已下线)北京市海淀区2022届高三一模(工业流程题)2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)福建省福州市2018届高三下学期5月模拟考试理综化学试题(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学湖南省长沙县第九中学2020-2021学年高二上学期第一次月考化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷
名校
解题方法
3 . 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_________________ 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
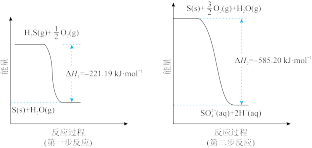
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为___________________ 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
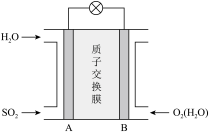
① 质子的流动方向为_____________ (“从A到B”或“从B到A”)。
② 负极的电极反应式为________ 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:

① 用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是__________________ 。
② 若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是______________ 。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

① 质子的流动方向为
② 负极的电极反应式为
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:

① 用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是
② 若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是
您最近一年使用:0次
2016-12-09更新
|
861次组卷
|
9卷引用:2016届北京市海淀区高三上学期期末考试化学试卷
2016届北京市海淀区高三上学期期末考试化学试卷北京市首都师范大学附属中学2020届高三北京学校联考化学试题北京市第一○一中学2022-2023学年高一下学期期末考试化学试题2017届北京市第三十一中学高三上学期期中化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷北京市第十中学2019届高三第一学期10月月考化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题02-2020年北京新高考化学模拟试题(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测
名校
4 . 已知:① 2C(s)+O2(g)=2CO(g);ΔH= -220kJ·mol-1
② 氢气燃烧的能量变化示意图:

下列说法正确的是
② 氢气燃烧的能量变化示意图:

下列说法正确的是
| A.1mol C(s)完全燃烧放出110 kJ的热量 |
| B.H2(g)+1/2O2(g)=H2O(g);ΔH= -480kJ·mol-1 |
| C.C(s)+H2O(g)=CO(g)+H2(g);ΔH= +130kJ·mol-1 |
| D.欲分解2mol H2O(l),至少需要提供4×462kJ的热量 |
您最近一年使用:0次
2016-12-09更新
|
333次组卷
|
8卷引用:2016届北京市海淀区高三上学期期末考试化学试卷
5 . 煤粉中的氮元素在使用过程中的转化关系如下图所示:

(1)②中NH3参与反应的化学方程式为__________ 。
(2)③中加入的物质可以是__________ (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更
),其分子中相邻的C和N原子相比,N原子吸引电子能力更__________ (填“强”或“弱”),从原子结构角度解释原因:_________ 。
(4)已知:N2(g) + O2(g)=2NO(g) ΔH = a kJ·mol-1
N2(g)+ 3H2(g)=2NH3(g) ΔH =b kJ·mol-1
2H2(g)+ O2(g)=2H2O(l) ΔH =c kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为__________ 。
(5)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:__________ 。
用离子方程式表示吸收池中除去NO的原理:__________ 。

(1)②中NH3参与反应的化学方程式为
(2)③中加入的物质可以是
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶(
 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更
),其分子中相邻的C和N原子相比,N原子吸引电子能力更(4)已知:N2(g) + O2(g)=2NO(g) ΔH = a kJ·mol-1
N2(g)+ 3H2(g)=2NH3(g) ΔH =b kJ·mol-1
2H2(g)+ O2(g)=2H2O(l) ΔH =c kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为
(5)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:
用离子方程式表示吸收池中除去NO的原理:
您最近一年使用:0次
2016-12-09更新
|
420次组卷
|
3卷引用:2015届北京市海淀区高三一模理综化学试卷
2010·北京海淀·一模
6 . A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的电子式是______ 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是_______ 。
(3)物质Z常用于对空气进行杀菌,净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是______ 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)____________________ 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是__________________ 。(已知甲醇的燃烧热△H= -726.5kJ·mol-1,氢气的燃烧热△H= -285.8kJ·mol-1)

(1)E的电子式是
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是
(3)物质Z常用于对空气进行杀菌,净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是
您最近一年使用:0次
2010·北京海淀·二模
7 . 近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=_______ 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知:T1<T2)

①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热)
N2(g)+O2(g)为(填“吸热”或“放热)_________ 反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号)
N2(g)+O2(g)已达到平衡的是(填序号)______ 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2=______________ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为_________________ 。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)
 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知:T1<T2)

①反应2NO(g)
 N2(g)+O2(g)为(填“吸热”或“放热)
N2(g)+O2(g)为(填“吸热”或“放热)②一定温度下,能够说明反应 2NO(g)
 N2(g)+O2(g)已达到平衡的是(填序号)
N2(g)+O2(g)已达到平衡的是(填序号)a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2=
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为
您最近一年使用:0次
8 . 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现已知火箭发射时可用肼(N2H4)为燃料,以NO2作氧化剂,反应生成N2(g)和气态的水,据下列的2个热化学反应方程式:
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式:____________ 。
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式:
您最近一年使用:0次



