1 . Ⅰ、776年,法国化学家拉瓦锡首次确认了硫元素。自然界天然的硫单质主要存在于火山区,
已知:
ⅰ、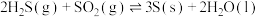
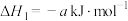
ⅱ、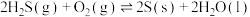
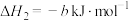 (a、b均大于0)
(a、b均大于0)
(1)根据上述信息,

___________  ;
;
Ⅱ、硫化氢的转化是资源利用和环境保护的重要研究课题。
ⅰ高温热分解法: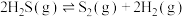

在总压强为120kPa恒压条件下,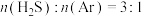 的混合气在不同温度下反应相同时间,测得
的混合气在不同温度下反应相同时间,测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:
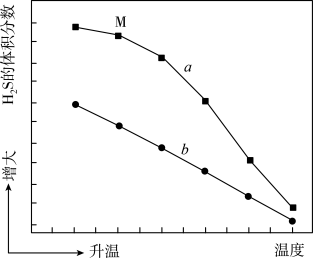
(2)图中表示平衡状态的曲线为___________ (填“a”或“b”)。
(3)下列关于高温热分解法的说法正确的有___________(填标号)。
(4)某温度下,平衡时 的体积分数为20%,则此时Ar的分压是
的体积分数为20%,则此时Ar的分压是___________ kPa;该反应的平衡常数
___________ 。
(5)随温度升高,图中a、b两条曲线逐渐靠近的原因是___________ 。
ⅱ电化学法:
(6)我国科学家设计了一种 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,工作原理如图所示。写出在电极b区发生的反应:
的高效去除,工作原理如图所示。写出在电极b区发生的反应:___________ 。
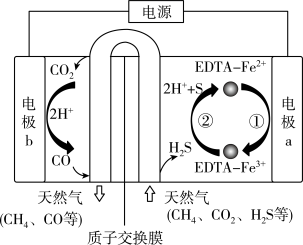
已知:
ⅰ、
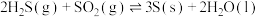
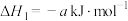
ⅱ、
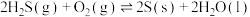
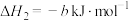 (a、b均大于0)
(a、b均大于0)(1)根据上述信息,


 ;
;Ⅱ、硫化氢的转化是资源利用和环境保护的重要研究课题。
ⅰ高温热分解法:
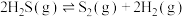

在总压强为120kPa恒压条件下,
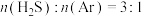 的混合气在不同温度下反应相同时间,测得
的混合气在不同温度下反应相同时间,测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:
(2)图中表示平衡状态的曲线为
(3)下列关于高温热分解法的说法正确的有___________(填标号)。
| A.图中M点正反应速率大于逆反应速率 |
| B.该反应平衡常数K随温度升高而减小 |
C.该反应平衡常数K随投料比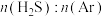 增大而增大 增大而增大 |
D.恒温恒压下,增加Ar的体积分数, 的平衡转化率增大 的平衡转化率增大 |
 的体积分数为20%,则此时Ar的分压是
的体积分数为20%,则此时Ar的分压是
(5)随温度升高,图中a、b两条曲线逐渐靠近的原因是
ⅱ电化学法:
(6)我国科学家设计了一种
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,工作原理如图所示。写出在电极b区发生的反应:
的高效去除,工作原理如图所示。写出在电极b区发生的反应:
您最近一年使用:0次
名校
2 . 我国科学家研究表明 甲基苄溴(
甲基苄溴( ,Ph代表苯基)在NaOH水溶液中水解的反应历程如图所示,下列说法正确的是
,Ph代表苯基)在NaOH水溶液中水解的反应历程如图所示,下列说法正确的是

 甲基苄溴(
甲基苄溴( ,Ph代表苯基)在NaOH水溶液中水解的反应历程如图所示,下列说法正确的是
,Ph代表苯基)在NaOH水溶液中水解的反应历程如图所示,下列说法正确的是
| A.TS1和TS2均为中间产物 |
| B.第二步反应的速率小于第一步反应的速率 |
| C.该水解反应分两步进行且两步反应均为吸热反应 |
D.总反应为 |
您最近一年使用:0次
名校
3 . 下列有关反应热的说法正确的是
A.25℃、 时, 时,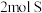 的燃烧热大于 的燃烧热大于 的燃烧热 的燃烧热 |
| B.在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 |
C.甲烷的燃烧热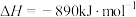 ,则甲烷燃烧的热化学方程式为 ,则甲烷燃烧的热化学方程式为 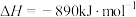 |
D.已知:  , ,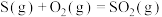 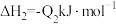 ,则 ,则 |
您最近一年使用:0次
解题方法
4 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
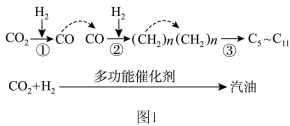
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
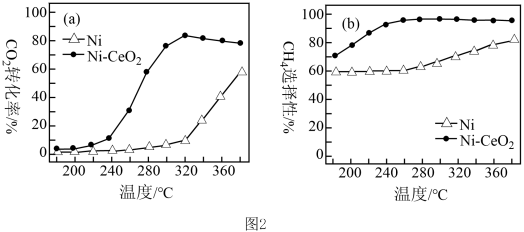
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍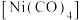 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

①反应

_______ 。(用含 和
和 的代数式表示)
的代数式表示)
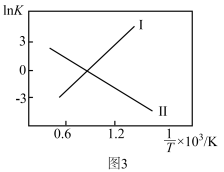
②反应Ⅰ、Ⅱ的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
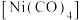 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


①反应


 和
和 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
363次组卷
|
3卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
解题方法
5 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g) CO2(g)+H2(g) ∆H2= –41.2kJ/mol
CO2(g)+H2(g) ∆H2= –41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= _________ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
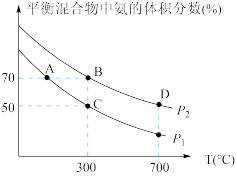
①恒压时,反应一定达到平衡状态的标志是_________ (填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C. 保持不变 D.
保持不变 D.
②P1_________ P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:B点_________ D点。
③C点 的转化率为
的转化率为_________ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)_________ υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_________ 。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/molb. CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2= –41.2kJ/mol
CO2(g)+H2(g) ∆H2= –41.2kJ/mol则反应CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= (2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.
 保持不变 D.
保持不变 D.
②P1
③C点
 的转化率为
的转化率为Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为
您最近一年使用:0次
名校
6 . 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
ii.2MnO(s)+O2(g) 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1
①反应i的化学平衡常数表达式K=_________ 。
②焙烧MnCO3制取MnO2的热化学方程式是_________ 。
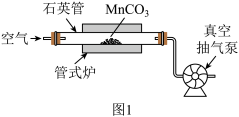
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_________ 。
(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。
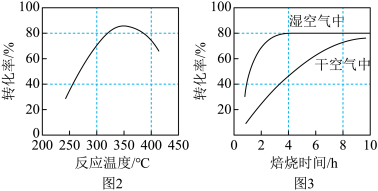
①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图_________ 。
②常压下,要提高MnCO3的转化率,应选择的生产条件是_________ 焙烧6~8h。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)
 MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1ii.2MnO(s)+O2(g)
 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1①反应i的化学平衡常数表达式K=
②焙烧MnCO3制取MnO2的热化学方程式是
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是

(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。

①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图
②常压下,要提高MnCO3的转化率,应选择的生产条件是
您最近一年使用:0次
2022-12-05更新
|
99次组卷
|
3卷引用:吉林省梅河口市第五中学2023-2024学年高二上学期12月月考化学试题
7 . 我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如图所示。

已知: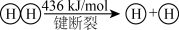 ;
; ;
;
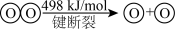 。下列说法
。下列说法不正确 的是

已知:
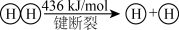 ;
; ;
;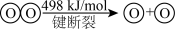 。下列说法
。下列说法| A.过程Ⅱ放出能量 |
| B.若分解2 mol H2O(g),估算出反应吸收482 kJ能量 |
| C.催化剂能减小水分解反应的焓变 |
| D.催化剂能降低反应的活化能,增大反应物分子中活化分子的百分数 |
您最近一年使用:0次
2022-12-03更新
|
240次组卷
|
22卷引用:吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题
吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题北京市西城区2020-2021学年高二上学期期末考试化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题湖南省长沙市明德中学 2021-2022学年高二上学期12月月考化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题山东省泰安市第一中学2021-2022学年高二上学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期第三次阶段考试化学试题北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题河南省宋基信阳实验中学2022-2023学年高三上学期11月月考化学试题 山东省济宁市泗水县2022-2023学年高二上学期期中考试化学试题湖南省株洲市第二中学2022-2023学年高三上学期第四次月考化学试题北京市西城职业学校2021-2021学年高二上学期期中测试化学试题北京市第四十三中学2021-2022学年高二上学期期中考试化学试题江西省永丰县永丰中学2022-2023学年高二上学期1月期末期末化学(A班)试题北京市育才学校2023-2024学年高二上学期10月月考化学试题北京师范大学第二附属中学2023-2024学年高二上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题湖南省长沙市第一中学2023-2024学年高三上学期月考卷(四)化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷北京市第五十中学2023-2024学年高二上学期12月月考化学试题湖北省武汉市新洲区部分学校2023-2024学年高三上学期期末考试化学试题
22-23高二上·河南商丘·阶段练习
8 . 利用乙烷甲醛化反应[ △H]制备乙醛具有广阔的应用前景和经济效益。回答下列问题:
△H]制备乙醛具有广阔的应用前景和经济效益。回答下列问题:
(1)已知:
反应Ⅰ:

反应Ⅱ:

则

_________ kJ/mol。
(2)898K时,将0.10mol 与0.40mol
与0.40mol  充入2.5L的空钢瓶中,仅发生反应
充入2.5L的空钢瓶中,仅发生反应
 ,10min末刚好达到平衡状态,测得此时的物质量分数为0.02。
,10min末刚好达到平衡状态,测得此时的物质量分数为0.02。
①0~10min内,用 (g)表示的平均反应速率
(g)表示的平均反应速率
_________  。
。
② 的平衡转化率
的平衡转化率 与
与 (g)的平衡转化率
(g)的平衡转化率 的比值为
的比值为_________ ,反应的平衡常数K=_________ (列出计算式即可)。
③其他条件不变,将容器改为绝热容器,则 (g)的平衡产率将
(g)的平衡产率将_________ (填“增大”“不变”或“减小”),原因为_________ 。
(3)在某催化剂作用下,乙烷催化氧化生成乙醛的反应路径如图所示:

在该催化剂上乙烷选择氧化生成乙醛的历程分_________ 步反应进行,历程中的最大能垒(活化能)为_________ eV。
 △H]制备乙醛具有广阔的应用前景和经济效益。回答下列问题:
△H]制备乙醛具有广阔的应用前景和经济效益。回答下列问题:(1)已知:
反应Ⅰ:


反应Ⅱ:


则


(2)898K时,将0.10mol
 与0.40mol
与0.40mol  充入2.5L的空钢瓶中,仅发生反应
充入2.5L的空钢瓶中,仅发生反应
 ,10min末刚好达到平衡状态,测得此时的物质量分数为0.02。
,10min末刚好达到平衡状态,测得此时的物质量分数为0.02。①0~10min内,用
 (g)表示的平均反应速率
(g)表示的平均反应速率
 。
。②
 的平衡转化率
的平衡转化率 与
与 (g)的平衡转化率
(g)的平衡转化率 的比值为
的比值为③其他条件不变,将容器改为绝热容器,则
 (g)的平衡产率将
(g)的平衡产率将(3)在某催化剂作用下,乙烷催化氧化生成乙醛的反应路径如图所示:

在该催化剂上乙烷选择氧化生成乙醛的历程分
您最近一年使用:0次
2022-11-30更新
|
116次组卷
|
4卷引用:原理综合题
名校
9 . 页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H。已知:
①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ∆H1
②H2(g)+ O2(g)⇌H2O(g) ∆H2
O2(g)⇌H2O(g) ∆H2
③CO(g)+ O2(g)⇌CO2(g) ∆H3
O2(g)⇌CO2(g) ∆H3
则∆H=_______ (用含∆H1、∆H2、∆H3的代数式表示)
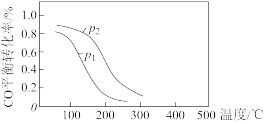
(2)用合成气生成甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) ∆H4,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
200℃时n(H2)随时间的变化如下表所示:
①该反应的平衡常数K=_______ ;∆H4=_______ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和CO转化率的措施:_______ 。
③下列说法正确的是_______ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~1min内用CH3OH表示的反应速率v(CH3OH)=_______ mol∙L-1∙min-1。
⑤向上述200℃达到平衡的恒容密闭容器中再加入2molCO、4molH2、2molCH3OH,保持温度不变,则化学平衡_______ (填“正向”“逆向”或“不”)移动。
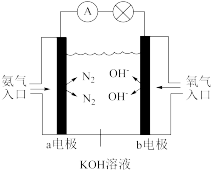
(3)如图是氨氧燃料电池示意图,该电池负极的电极反应式为_______ 。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H。已知:
①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ∆H1
②H2(g)+
 O2(g)⇌H2O(g) ∆H2
O2(g)⇌H2O(g) ∆H2
③CO(g)+
 O2(g)⇌CO2(g) ∆H3
O2(g)⇌CO2(g) ∆H3则∆H=
(2)用合成气生成甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) ∆H4,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:

200℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
②写出一条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~1min内用CH3OH表示的反应速率v(CH3OH)=
⑤向上述200℃达到平衡的恒容密闭容器中再加入2molCO、4molH2、2molCH3OH,保持温度不变,则化学平衡
(3)如图是氨氧燃料电池示意图,该电池负极的电极反应式为

您最近一年使用:0次
名校
10 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
I.
II.

III.

回答下列问题:
(1)
_______ 。
(2)将2.0mol 和3.0mol
和3.0mol  通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
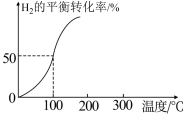
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为_______ 。
②100℃时,反应II的平衡常数K=_______ 。
③下列可用来判断该反应已达到平衡状态的有_______ (填标号)。
A.CO的含量保持不变 B.容器中
C.容器中混合气体的密度保持不变 D.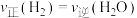
(3)利用天然气制取合成气的原理 ,在密闭容器中通入物质的量浓度均为1
,在密闭容器中通入物质的量浓度均为1 的
的 与
与 ,在一定条件下发生反应,测得
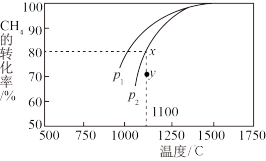
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
_______  (填“大于”或“小于”);压强为
(填“大于”或“小于”);压强为 时,在Y点:
时,在Y点:
_______  (填“大于”“小于”或“等于”)。为了提高该反应中
(填“大于”“小于”或“等于”)。为了提高该反应中 的转化率,除温度、压强外还可以采取的措施是
的转化率,除温度、压强外还可以采取的措施是_______ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:I.

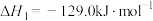
II.


III.


回答下列问题:
(1)

(2)将2.0mol
 和3.0mol
和3.0mol  通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应II的平衡常数K=
③下列可用来判断该反应已达到平衡状态的有
A.CO的含量保持不变 B.容器中

C.容器中混合气体的密度保持不变 D.
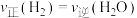
(3)利用天然气制取合成气的原理
 ,在密闭容器中通入物质的量浓度均为1
,在密闭容器中通入物质的量浓度均为1 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“大于”或“小于”);压强为
(填“大于”或“小于”);压强为 时,在Y点:
时,在Y点:
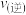 (填“大于”“小于”或“等于”)。为了提高该反应中
(填“大于”“小于”或“等于”)。为了提高该反应中 的转化率,除温度、压强外还可以采取的措施是
的转化率,除温度、压强外还可以采取的措施是
您最近一年使用:0次
2022-11-19更新
|
118次组卷
|
2卷引用:吉林省长春市第二实验中学2022-2023学年高二上学期期中考试化学试题



