名校
1 . 用酸性高锰酸钾溶液与草酸( )溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是
)溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是

 )溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是
)溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 实验温度/℃ | 溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 溶液 溶液 |  | 3mol·L-1 溶液 溶液 | 0.05mol·L-1 溶液 溶液 | |||
| Ⅰ | 2.0 |  | 2.0 | 3.0 | 20 | 2.6 |
| Ⅱ |  | 2.0 | 2.0 | 3.0 | T | 1.4 |
| Ⅲ | 2.0 | 3.0 | 2.0 | 3.0 | 45 | 1.0 |

A.某同学认为也可以通过改变 溶液的浓度探究浓度变化对速率的影响 溶液的浓度探究浓度变化对速率的影响 |
B. 后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 |
C.实验Ⅲ中,从反应开始至 溶液褪至无色时间段内, 溶液褪至无色时间段内, mol⋅L-1⋅min-1 mol⋅L-1⋅min-1 |
D. |
您最近一年使用:0次
名校
2 . 一定温度下,某体系中2-溴丁烷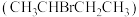 同时发生反应:
同时发生反应:
①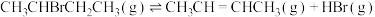 2-丁烯
2-丁烯
②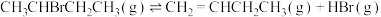 1-丁烯
1-丁烯
反应①的速率表示为 ,反应②的速率表示为
,反应②的速率表示为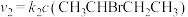 (
( ,
, 为速率常数。只与温度、活化能有关)。体系中生成物的浓度时间的关系如图所示。
为速率常数。只与温度、活化能有关)。体系中生成物的浓度时间的关系如图所示。
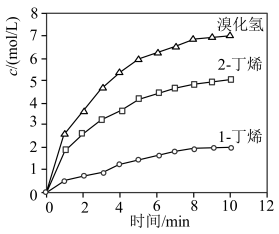
下列说法错误的是
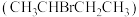 同时发生反应:
同时发生反应:①
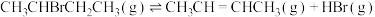 2-丁烯
2-丁烯②
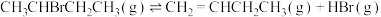 1-丁烯
1-丁烯反应①的速率表示为
 ,反应②的速率表示为
,反应②的速率表示为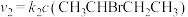 (
( ,
, 为速率常数。只与温度、活化能有关)。体系中生成物的浓度时间的关系如图所示。
为速率常数。只与温度、活化能有关)。体系中生成物的浓度时间的关系如图所示。
下列说法错误的是
| A.反应①和2均是熵增反应 |
B.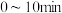 内,2-溴丁烷的平均反应速率为 内,2-溴丁烷的平均反应速率为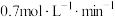 |
| C.其他条件不变时,反应①的活化能比反应②的活化能大 |
| D.温度不变,反应过程中2-丁烯,1-丁烯生成速率比值不变 |
您最近一年使用:0次
名校
3 . 在反应器中充入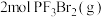 ,发生反应:
,发生反应: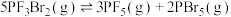 ,测得不同条件下
,测得不同条件下 的物质的量与时间的关系如图所示。下列说法错误的是
的物质的量与时间的关系如图所示。下列说法错误的是

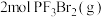 ,发生反应:
,发生反应: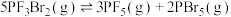 ,测得不同条件下
,测得不同条件下 的物质的量与时间的关系如图所示。下列说法错误的是
的物质的量与时间的关系如图所示。下列说法错误的是
A.平衡时,体系中有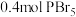 |
| B.若乙没有加入催化剂,则甲一定加入了催化剂 |
C.甲条件下,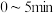 内 内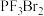 的平均反应速率约为 的平均反应速率约为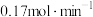 |
D.乙条件下,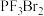 的平衡转化率为50% 的平衡转化率为50% |
您最近一年使用:0次
名校
解题方法
4 . 某温度下,在2L恒容密闭容器中4.0molX发生反应 ,有关数据如下:
,有关数据如下:
下列说法正确的是
 ,有关数据如下:
,有关数据如下:| 时间段/min | 产物Z的平均生成速率/ |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
A.0~2min内,X平均反应速率为 |
B.2min时,加入0.40molZ,此时 |
| C.当Z的气体体积分数约为66.7%,说明反应一定处于平衡状态 |
| D.5min时,Y的物质的量为0.3mol |
您最近一年使用:0次
名校
5 . 某实验小组用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素。他们通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计方案如下(KMnO4溶液已酸化):
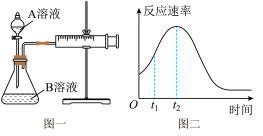
(1)酸性KMnO4溶液中所加的酸应是(填字母序号)______。
(2)写出酸性KMnO4溶液和H2C2O4反应离子方程式:______ 。
(3)该实验探究的是______ 对化学反应速率的影响。
(4)实验停止前,相同时间内针筒中所得CO2体积较大是______ (填实验序号)。
(5)若实验①在2min末注射器的活塞从最左端向右移动到了VmL的位置,则这段时间内的平均反应速率可表示为
______  。
。
(6)若实验②在tmin收集了2.24mLCO2(标准状况),则tmin末 的物质的量浓度为
的物质的量浓度为______  。
。
(7)该小组同学发现反应速率总是如图二,其中 时间内速率变快的主要原因可能是:①
时间内速率变快的主要原因可能是:①______ 。②______ 。

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL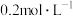 H2C2O4溶液 H2C2O4溶液 | 30mL KMnO4溶液 KMnO4溶液 |
| ② | 20mL H2C2O4溶液 H2C2O4溶液 | 30mL KMnO4溶液 KMnO4溶液 |
(1)酸性KMnO4溶液中所加的酸应是(填字母序号)______。
| A.硫酸 | B.盐酸 | C.硝酸 | D.以上三种酸都可 |
(2)写出酸性KMnO4溶液和H2C2O4反应离子方程式:
(3)该实验探究的是
(4)实验停止前,相同时间内针筒中所得CO2体积较大是
(5)若实验①在2min末注射器的活塞从最左端向右移动到了VmL的位置,则这段时间内的平均反应速率可表示为

 。
。(6)若实验②在tmin收集了2.24mLCO2(标准状况),则tmin末
 的物质的量浓度为
的物质的量浓度为 。
。(7)该小组同学发现反应速率总是如图二,其中
 时间内速率变快的主要原因可能是:①
时间内速率变快的主要原因可能是:①
您最近一年使用:0次
名校
6 . 已知:
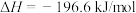 。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时测得体系的压强减小了30%。下列说法正确的是
。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时测得体系的压强减小了30%。下列说法正确的是

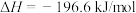 。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时测得体系的压强减小了30%。下列说法正确的是
。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时测得体系的压强减小了30%。下列说法正确的是| A.5min时SO2的转化率为30% |
| B.5min时反应共放出了137.62kJ的热量 |
C.用O2表示的5min内的平均反应速率为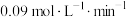 |
| D.若将反应起始温度提高到500℃,反应达到此状态的时间小于5min,其本质原因是反应体系中活化分子的数量和百分数均增加,增加了有效碰撞几率 |
您最近一年使用:0次
7 . 在一刚性密闭容器内发生反应 ,若
,若 内
内 减少了
减少了 ,则下列说法正确的是
,则下列说法正确的是
 ,若
,若 内
内 减少了
减少了 ,则下列说法正确的是
,则下列说法正确的是A.反应达到平衡时 |
| B.容器内气体总密度不再改变是该反应达到平衡的标志之一 |
C. 内用B表示反应速率为 内用B表示反应速率为 |
| D.升高温度能加快反应速率主要是其使活化分子的能量明显增加 |
您最近一年使用:0次
2023-12-31更新
|
68次组卷
|
2卷引用:安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
8 . 在恒容密闭容器中通入X并发生反应:2X(g)=Y(g),T1、T2温度下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是


| A.该反应进行到M点放出的热量大于进行到W点放出的热量 |
| B.T2温度下,在0- t1,时间内,v(Y)=a-b/t1mol·L-1min-1 |
| C.该反应的ΔH<0 |
| D.M点时向容器内充入一定量惰性气体,平衡向正反应方向移动 |
您最近一年使用:0次
2023-12-27更新
|
114次组卷
|
2卷引用:安徽省马鞍山市当涂第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
9 . 300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:
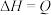 ,2min末达到平衡,生成0.8molD。
,2min末达到平衡,生成0.8molD。
(1)300℃时,该反应的平衡常数表达式为:
_______ 。已知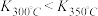 ,则
,则
_______ 0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为_______ ,D的平均反应速率为_______ 。
(3)若温度不变,缩小容器容积,则A的转化率_______ (填“增大”“减小”或“不变”),原因是_______ 。
(4)恒温恒容下,A容器中加入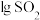 和
和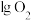 反应达到平衡,
反应达到平衡, 的转化率为a%,另一同温同容的B容器中加入
的转化率为a%,另一同温同容的B容器中加入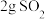 和
和 反应达到平衡,
反应达到平衡, 的转化率为b%,则比较大小:a%
的转化率为b%,则比较大小:a%_______ b%。

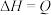 ,2min末达到平衡,生成0.8molD。
,2min末达到平衡,生成0.8molD。(1)300℃时,该反应的平衡常数表达式为:

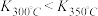 ,则
,则
(2)在2min末时,B的平衡浓度为
(3)若温度不变,缩小容器容积,则A的转化率
(4)恒温恒容下,A容器中加入
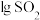 和
和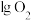 反应达到平衡,
反应达到平衡, 的转化率为a%,另一同温同容的B容器中加入
的转化率为a%,另一同温同容的B容器中加入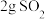 和
和 反应达到平衡,
反应达到平衡, 的转化率为b%,则比较大小:a%
的转化率为b%,则比较大小:a%
您最近一年使用:0次
名校
10 . 反应 中,每生成0.25molN2放出166kJ的热量,该反应的速率表达式为
中,每生成0.25molN2放出166kJ的热量,该反应的速率表达式为 (k、m、n待测),其反应包含两步:①
(k、m、n待测),其反应包含两步:① (慢)②
(慢)②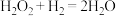 (快)T℃时测得有关实验数据如下:
(快)T℃时测得有关实验数据如下:
下列说法正确的是
 中,每生成0.25molN2放出166kJ的热量,该反应的速率表达式为
中,每生成0.25molN2放出166kJ的热量,该反应的速率表达式为 (k、m、n待测),其反应包含两步:①
(k、m、n待测),其反应包含两步:① (慢)②
(慢)②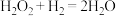 (快)T℃时测得有关实验数据如下:
(快)T℃时测得有关实验数据如下:| 序号 |  |  | 速率 |
| Ⅰ | 0.0060 | 0.0010 | 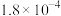 |
| Ⅱ | 0.0060 | 0.0020 |  |
| Ⅲ | 0.0010 | 0.0060 |  |
| Ⅳ | 0.0020 | 0.0060 | 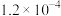 |
A.该反应的热化学方程式为  |
| B.正反应的活化能一定是①<② |
C.该反应速率表达式: |
| D.整个反应速率由第②步反应决定 |
您最近一年使用:0次
2023-12-25更新
|
35次组卷
|
2卷引用:安徽省黄山市2023-2024学年屯溪一中高一上学期10月化学月考



