名校
1 . 在温度均为T℃的密闭容器中发生反应: 2SO2(g) + O2(g)  2SO3(g) ΔH<0。下列说法正确的是
2SO3(g) ΔH<0。下列说法正确的是
 2SO3(g) ΔH<0。下列说法正确的是
2SO3(g) ΔH<0。下列说法正确的是| 容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 达平衡时SO3 物质的量/mol | 达平衡需要的时间/min | ||
| SO2 | O2 | SO3 | |||||
| Ⅰ | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 | 5 |
| Ⅱ | 恒温恒压 | 1.0 L | 2 | 1 | 0 | a | t |
| A.a < 1.6 t < 5 |
| B.选择不同的催化剂,该反应的反应速率和平衡转化率都将不同 |
| C.反应达到平衡时,装置Ⅱ中SO2平均反应速率v = 0.32 mol·L-1·min-1 |
| D.若起始时向容器Ⅰ中充入1 mol SO2、0.2 mol O2和4 mol SO3,则反应不移动 |
您最近一年使用:0次
2021-02-03更新
|
1243次组卷
|
4卷引用:四川省资阳中学2021-2022学年高二下学期3月月考化学试题
四川省资阳中学2021-2022学年高二下学期3月月考化学试题安徽省黄山市2020-2021学年高二上学期期末考试化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.3 影响化学平衡的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
名校
解题方法
2 . 利用辉钼矿冶炼组的原理为
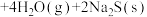
 。在压强为
。在压强为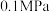 的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:
的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:

下列判断正确的是

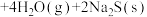
 。在压强为
。在压强为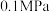 的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:
的条件下,测得达到平衡时的有关气体体积分数的变化如图中实线所示:
下列判断正确的是
A.通过图象曲线变化规律无法判断 正负 正负 |
| B.a为CO变化曲线,b为水蒸气变化曲线 |
C.压强为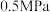 时,虚线Ⅱ可能为 时,虚线Ⅱ可能为 的变化曲线 的变化曲线 |
D.M点 的转化率为75% 的转化率为75% |
您最近一年使用:0次
2021-01-26更新
|
660次组卷
|
8卷引用:重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题
重庆市缙云教育联盟2021-2022学年高三9月月度质量检测化学试题吉林省长春市十一高中2022届高三上学期第一学程考试化学试题湖南省攸县长鸿实验中学2022-2023学年高三第四次月考化学试题山西省运城市2020-2021学年高二上学期期末考试化学试题(已下线)解密09 化学反应速率与平衡(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时38 化学平衡常规图像-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第4讲 化学反应速率及平衡图像
名校
解题方法
3 . 可逆反应 ,
, 。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使
。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使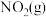 百分含量减小,应采取的措施是
百分含量减小,应采取的措施是
 ,
, 。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使
。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使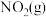 百分含量减小,应采取的措施是
百分含量减小,应采取的措施是| A.增大容器体积 | B.温度体积不变,充入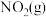 |
C.温度压强不变,充入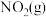 | D.温度体积不变,充入N2O4(g) |
您最近一年使用:0次
2021-01-02更新
|
268次组卷
|
3卷引用:山东省济宁市实验中学2020-2021学年高二上学期10月月考化学试题
解题方法
4 . 向绝热恒容密闭容器中通入一定量的SO2和NO2,一定条件下发生反应: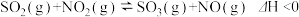 ,测得SO3浓度随时间变化如下所示,下列说法正确的是
,测得SO3浓度随时间变化如下所示,下列说法正确的是
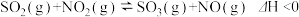 ,测得SO3浓度随时间变化如下所示,下列说法正确的是
,测得SO3浓度随时间变化如下所示,下列说法正确的是| 反应时间/s | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
| SO3浓度/mol/L | 0.10 | 0.14 | 0.21 | 0.26 | 0.30 | 0.32 | 0.33 | 0.33 |
| A.50s时,SO3的生成速率为0.0028mol·L-1·s-1 |
| B.40~90s的逆反应速率逐渐增大 |
| C.40~50s的反应速率大于70~80s的反应速率 |
| D.110s时,缩小容器体积再次达到平衡后,SO2的转化率和浓度均保持不变 |
您最近一年使用:0次
2020-12-10更新
|
281次组卷
|
2卷引用:内蒙古北京四中呼和浩特分校2021-2022学年高二上学期第一次月考化学试题
名校
5 . 只知某反应向正反应方向移动,下列说法不正确 的是
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
| A.只有①② | B.只有①②③ | C.只有③④ | D.①②③④ |
您最近一年使用:0次
2020-11-23更新
|
569次组卷
|
6卷引用:浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题
浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题黑龙江省龙西北八校联合体2022-2023学年高二上学期第一次月考化学试题吉林省东北师范大学连山实验高中2023-2024学年高二上学期第一次月考化学试题浙江省东阳中学2020-2021学年高二上学期期中考试化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
6 . 在相同温度相同体积的甲、乙两密闭容器中,分别充入1molN2和3molH2,甲保持恒温恒压,乙保持恒温恒容,发生反应:N2(g) + 3H2(g)⇌2NH3(g) ΔH<0。下列说法错误的是
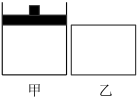

| A.甲容器中反应达到平衡时,再向容器内充入1 mol 稀有气体,平衡逆向移动 |
| B.两容器内的反应达到化学平衡状态所需时间: t甲>t乙 |
| C.当甲中N2的平衡转化率为10%时,乙中N2的转化率小于10% |
| D.乙容器中反应达到平衡时,再向容器内充入1 mol N2,则平衡正向移动 |
您最近一年使用:0次
名校
7 . 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5 (g)  PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是
 PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是| 容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
 | 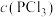 | 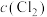 | 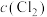 | |
| Ⅰ | 0.4 | 0 | 0 | 0.2 |
| Ⅱ | 0.6 | 0 | 0.2 | |
| Ⅲ | 0.8 | 0 | 0 | |
A.反应达到平衡时,容器I中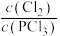 比容器Ⅱ中的小 比容器Ⅱ中的小 |
| B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4 |
C.反应达到平衡时,容器Ⅲ中 的体积分数小于 的体积分数小于 |
| D.反应达到平衡时,容器Ⅲ中0.4mol/L<c(PCl5)<0.8 mol/L |
您最近一年使用:0次
2020-09-29更新
|
725次组卷
|
6卷引用:江西省赣州市会昌县七校2021届高三联合9月月考化学试题
12-13高三上·黑龙江·阶段练习
名校
解题方法
8 . 如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和l mol O2,乙中充入4 mol SO3和1 mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3 (g) ⇌ 2SO2 (g) + O2 (g)。下列有关说法正确的是


| A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲 |
| B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度:c (SO3) 乙>2c (SO3)甲 |
| C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ (SO2)乙>2ψ (SO2)甲 |
| D.若活塞固定在7处不动,达平衡时两容器中SO2的物质的量分数相等 |
您最近一年使用:0次
2020-09-16更新
|
579次组卷
|
7卷引用:2013届黑龙江省哈三中高三10月月考化学试卷
(已下线)2013届黑龙江省哈三中高三10月月考化学试卷2016届黑龙江省哈尔滨三中高三上学期第二次检测化学试卷黑龙江省哈尔滨市第三中学2019-2020学年高二10月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一次阶段考试化学试题(已下线)2012-2013学年黑龙江省哈三中高二上学期期中考试化学试卷浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题内蒙古赤峰市红山区2021-2022学年高二上学期期末联考化学试题
名校
9 . 已知反应: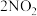 (红棕色)
(红棕色)
 (无色),分别进行如下两个实验:
(无色),分别进行如下两个实验:
实验ⅰ:将 球分别浸泡在热水和冰水中,现象如图1。
球分别浸泡在热水和冰水中,现象如图1。
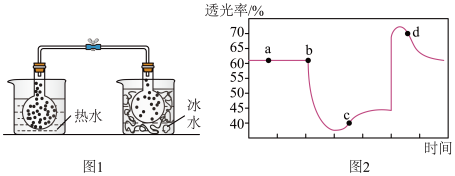
实验ⅱ:将一定量的 充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(
充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小 ),如图2。下列说法不正确 的是( )
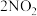 (红棕色)
(红棕色)
 (无色),分别进行如下两个实验:
(无色),分别进行如下两个实验:实验ⅰ:将
 球分别浸泡在热水和冰水中,现象如图1。
球分别浸泡在热水和冰水中,现象如图1。实验ⅱ:将一定量的
 充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(
充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(
| A.图1现象说明该反应为放热反应 |
| B.图2中b点的操作是压缩注射器 |
C.d点: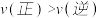 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
您最近一年使用:0次
2020-09-06更新
|
170次组卷
|
2卷引用:陕西省安康市安康中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
10 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
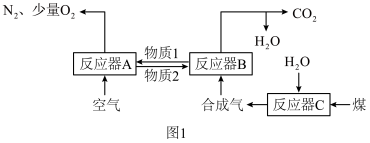
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
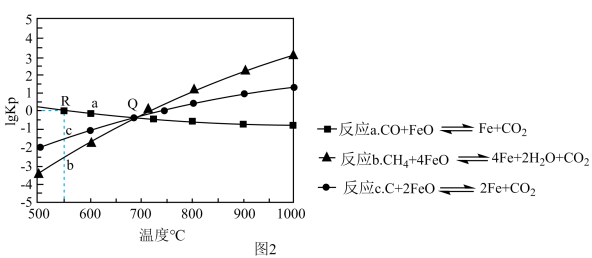
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
292次组卷
|
5卷引用:云南省昆明市第一中学2020届高三上学期12月月考理综试卷化学试题



