名校
解题方法
1 . 在一密闭容器中充入2molA和1molB发生反应:2A(g)+B(g)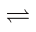 xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为( )
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为( )
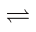 xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为( )
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为( )| A.只能为2 | B.只能为3 | C.只能为4 | D.可能为2或3 |
您最近一年使用:0次
名校
2 . 已知反应:2NO2(红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
 N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是压缩注射器 |
| B.d 点:v正>v逆 |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc |
您最近一年使用:0次
2020-04-30更新
|
840次组卷
|
15卷引用:2015届北京市海淀区高三年级3月适应性训练理综化学试卷
2015届北京市海淀区高三年级3月适应性训练理综化学试卷2015届福建省漳州市高三5月适应性考试化学试卷安徽省涡阳县第一中学2019-2020学年高二12月月考化学试题内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题重庆市大足中学2022-2023学年高二上学期学期第一次月考化学试题四川省华蓥中学2023-2024学年高二上学期9月月考化学试题2016-2017学年安徽省师大附中高二上期中化学试卷河北省唐山遵化市2019-2020学年高二上学期期中考试化学试题甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题湖南师范大学附属中学2022-2023学年高一下学期期末考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期开学考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题
名校
3 . 一定温度下将CaCO3放入密闭真空容器中,反应CaCO3(s) CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
 CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是| A.平衡向左移动 | B.压强不变 |
| C.平衡常数不变 | D.固体总质量不变 |
您最近一年使用:0次
2020-04-28更新
|
297次组卷
|
4卷引用:【浙江新东方】高中化学20210513-044【2021】【高二下】
(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】山东省日照市2018-2019学年高二上学期期末模块考试化学试题(已下线)2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷01广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
4 . 为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__ 。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___ 。
②在该温度下反应的平衡常数K=___ 。
③关于上述反应,下列叙述正确的是___ (填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:
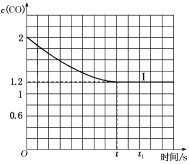
若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___ (不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:
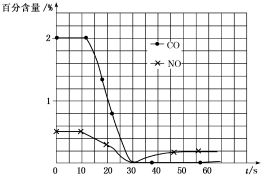
请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___ 。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=
②在该温度下反应的平衡常数K=
③关于上述反应,下列叙述正确的是
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是
您最近一年使用:0次
名校
解题方法
5 . 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
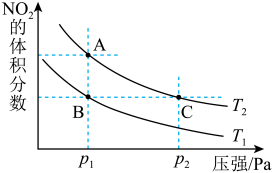
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1051次组卷
|
9卷引用:湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题
湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题
12-13高三上·上海虹口·阶段练习
解题方法
6 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I. 利用反应:6NO2 + 8NH3 7N2 + 12H2O处理NO2。
7N2 + 12H2O处理NO2。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =_________ 。
II. 一定条件下SO2与NO2可发生反应,方程式:NO2(g)+SO2(g) SO3(g)+NO(g)- Q。
SO3(g)+NO(g)- Q。
(2)将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是____ 。
a 体系压强保持不变 b 混合气体颜色保持不变
c NO2和SO3的体积比保持不变 d 混合气体的平均相对分子质量保持不变
(3)如果上述反应的平衡常数K值变大,该反应___________ (填序号)。
a 一定向正反应方向移动 b 平衡移动时,正反应速率先减小后增大
c 一定向逆反应方向移动 d 平衡移动时,逆反应速率先增大后减小
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g) CH3OH(g) 。
CH3OH(g) 。
(4)CO在不同温度下的平衡转化率与压强的关系如图示。
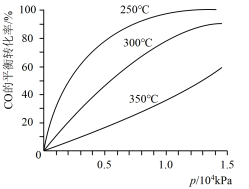
该反应是_______ 反应(填“放热”或“吸热”)。实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:___________ 。
I. 利用反应:6NO2 + 8NH3
 7N2 + 12H2O处理NO2。
7N2 + 12H2O处理NO2。(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =
II. 一定条件下SO2与NO2可发生反应,方程式:NO2(g)+SO2(g)
 SO3(g)+NO(g)- Q。
SO3(g)+NO(g)- Q。(2)将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是
a 体系压强保持不变 b 混合气体颜色保持不变
c NO2和SO3的体积比保持不变 d 混合气体的平均相对分子质量保持不变
(3)如果上述反应的平衡常数K值变大,该反应
a 一定向正反应方向移动 b 平衡移动时,正反应速率先减小后增大
c 一定向逆反应方向移动 d 平衡移动时,逆反应速率先增大后减小
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g) 。
CH3OH(g) 。(4)CO在不同温度下的平衡转化率与压强的关系如图示。

该反应是
您最近一年使用:0次
名校
解题方法
7 . 燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。已知:25℃ 时,Kb(NH3·H2O)=1.8×10-5; H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7。
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____ (填“>”“<”或“=”)7。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) ⇌ N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到平衡状态的依据是________ (填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式__________________ 。
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:
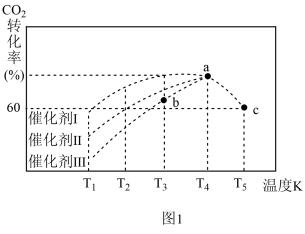
催化剂效果最佳的是催化剂________ (填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v( 正 )________ v( 逆 )( 填“>”“<”或“=”) 。此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因_____ 。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=____________ KPa-2。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
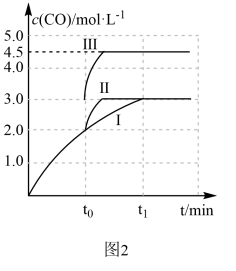
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH<0,一定温度下,在3L容积可变的密闭容器中发生如上反应,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是____________________ 。
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) ⇌ N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到平衡状态的依据是
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:

催化剂效果最佳的是催化剂
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH<0,一定温度下,在3L容积可变的密闭容器中发生如上反应,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是

您最近一年使用:0次
8 . 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
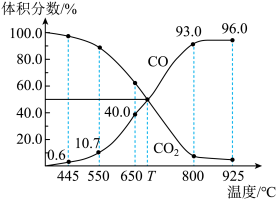
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
| A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动 |
| B.T℃时,反应达平衡后CO2的转化率为50% |
| C.T℃时,若充入等体积的CO2和CO,平衡不移动 |
| D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总 |
您最近一年使用:0次
2020-03-03更新
|
317次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题
9 . 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________ (用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________ ;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________ (填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____ 2.1mol(填“<”、“>”或“=”),简单说明原因:____________ 。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________ v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
用“<”、“>”或“=”填入下列横线上:
c2______ 2c1,v1______ v2;K1_____ K3,p2____ 2p3;α1(SO2)_____ α3(SO2);α2(SO3)+α3(SO2)_______ 1
 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=
(2)反应进行到t1时,SO2的体积分数为
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)
 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
| 平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2
您最近一年使用:0次
2020-02-21更新
|
453次组卷
|
3卷引用:江苏省宿豫中学2019-2020学年度高二下学期调研测试(实验班)化学试题
江苏省宿豫中学2019-2020学年度高二下学期调研测试(实验班)化学试题江苏省启东中学2019-2020学年高二上学期期末考试化学试题(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
10 . 甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________ (填“>”或“<”)0,△H1=________ (用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
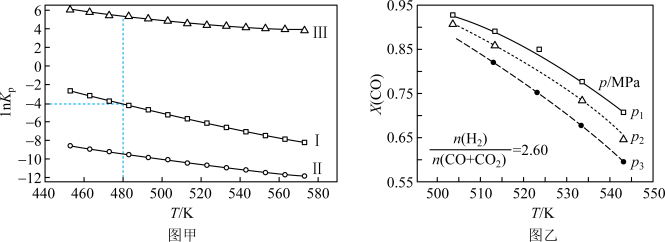
①反应(Ⅱ)的△H________ (填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________ 。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________ (KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制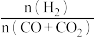 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____ (填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大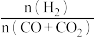 ,X(CO)增大
,X(CO)增大
Ⅰ.CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
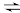 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示

①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
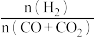 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
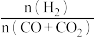 ,X(CO)增大
,X(CO)增大
您最近一年使用:0次



