名校
1 . 将NO2装入带活塞的密闭容器中,当反应2NO2(g)⇌N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
| A.恒温恒压时,充入少量惰性气体,平衡向右移动,混合气体的颜色变浅 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
您最近一年使用:0次
2021-07-28更新
|
686次组卷
|
7卷引用:海南省屯昌县屯昌中学2021-2022学年高二上学期10月月考化学试题
海南省屯昌县屯昌中学2021-2022学年高二上学期10月月考化学试题重庆市实验中学2021-2022学年上学期高二10月月考化学试题广东省珠海市第二中学2022-2023学年高二上学期10月月考化学试题内蒙古杭锦后旗奋斗中学2020-2021学年高二上学期期中考试化学试题(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省广州市第一中学2022-2023学年高二上学期期中考试化学试题
2 . “绿水青山就是金山银山”,因此研究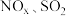 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1)燃煤发电厂常利用反应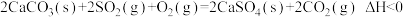 ,对煤进行脱硫处理来减少
,对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时,借助传感器测得反应在不同时间点上各物质的浓度如表:
 内,平均反应速率
内,平均反应速率
_______  ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K_______ (填“增大”“减小”或“不变")。
(2) 主要来自于汽车尾气的排放,包含
主要来自于汽车尾气的排放,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应
进行吸附,发生反应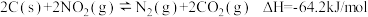 。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的
。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的 气体,维持温度为
气体,维持温度为 ,如图为不同压强下,该反应经过相同时间,
,如图为不同压强下,该反应经过相同时间, 的转化率随压强变化的示意图。
的转化率随压强变化的示意图。
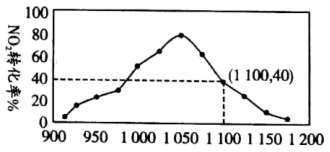
①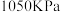 前,反应中
前,反应中 转化率随着压强增大而增大的原因
转化率随着压强增大而增大的原因_______ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 )。在
)。在 、
、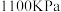 时,该反应的化学平衡常数
时,该反应的化学平衡常数
_______ (计算结果保留小数点后两位)。已知:气体分压(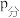 )=气体总压(
)=气体总压(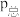 )×体积分数。
)×体积分数。
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中 和
和 发生反应
发生反应 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得,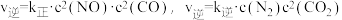 (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“>”“<”或“=”) 增大的倍数。
增大的倍数。
②若在 的密闭容器中充入
的密闭容器中充入 和
和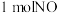 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则
_______ 。
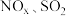 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。(1)燃煤发电厂常利用反应
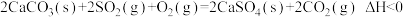 ,对煤进行脱硫处理来减少
,对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时,借助传感器测得反应在不同时间点上各物质的浓度如表: | 0 | 10 | 20 | 30 | 40 | 50 |
 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
 内,平均反应速率
内,平均反应速率
 ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K(2)
 主要来自于汽车尾气的排放,包含
主要来自于汽车尾气的排放,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应
进行吸附,发生反应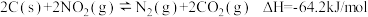 。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的
。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的 气体,维持温度为
气体,维持温度为 ,如图为不同压强下,该反应经过相同时间,
,如图为不同压强下,该反应经过相同时间, 的转化率随压强变化的示意图。
的转化率随压强变化的示意图。
①
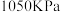 前,反应中
前,反应中 转化率随着压强增大而增大的原因
转化率随着压强增大而增大的原因②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作
 )。在
)。在 、
、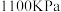 时,该反应的化学平衡常数
时,该反应的化学平衡常数
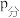 )=气体总压(
)=气体总压(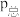 )×体积分数。
)×体积分数。(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中
 和
和 发生反应
发生反应 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得,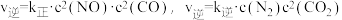 (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②若在
 的密闭容器中充入
的密闭容器中充入 和
和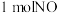 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则
您最近一年使用:0次
3 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ⇌2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列见表,下列说法错误的是
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大 |
| B.当混合气体平均相对分子质量为26时说明该反应已达平衡 |
| C.根据表中数据,计算25.0 ℃时分解的浓度平衡常数约为1.6×10-8 mol3/L3 |
| D.若保持温度和容器体积不变,平衡后再充入n(NH3)∶n(CO2)=2∶1,则再次达到平衡时c(NH3)不变 |
您最近一年使用:0次
2021-04-07更新
|
440次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二下学期第一次月考化学(理)试题
名校
解题方法
4 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
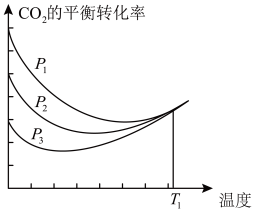
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1259次组卷
|
10卷引用:河北省武邑中学2021届高考七模化学试题
河北省武邑中学2021届高考七模化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷
名校
5 . 根据如图所示所得推论正确的是
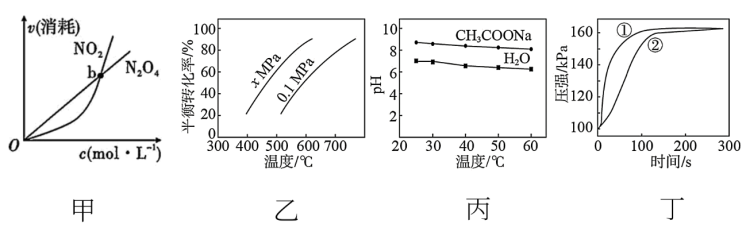

A.若图甲表示恒温恒容条件下,反应 中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态 中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态 |
B.图乙是 的平衡转化率与温度和压强的关系曲线,推断该反应的ΔH>0、x>0.1 的平衡转化率与温度和压强的关系曲线,推断该反应的ΔH>0、x>0.1 |
| C.图丙是0.5 mol∙L−1CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小 |
| D.图丁是0.03 g镁条分别与2 mL 2 mol∙L−1盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断曲线①代表盐酸与镁条的反应 |
您最近一年使用:0次
6 . 向两个体积可变的密闭容器中均充入1mol的A和2mol的B,发生反应:A2(g)+2B2(g)⇌2AB2(g)ΔH.维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
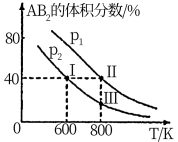
已知:①图中I、II、III点均处于曲线上;②点II时容器的体积为0.1L。下列叙述正确的是

已知:①图中I、II、III点均处于曲线上;②点II时容器的体积为0.1L。下列叙述正确的是
| A.由图象可知:p1<p2 ΔH<0 |
| B.点I时A2的平衡转化率为40% |
| C.点III所对应的反应平衡常数K=0.2 |
| D.将点II所对应的容器冷却到600K,不可能变成点I |
您最近一年使用:0次
名校
解题方法
7 . 苯乙烯是石油化学工业的重要原料之一。世界上90%以上的苯乙烯是采用乙苯催化脱氢法制得。具体反应为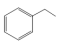 (g)
(g)
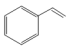 (g)+H2(g) ∆H=+124kJ/mol。
(g)+H2(g) ∆H=+124kJ/mol。
(1)相关物质的相对能量如表所示:
则苯乙烯(g)的相对能量为___ kJ•mol-1。
(2)工业上通常在乙苯蒸气中掺入水蒸气(物质的量之比为1:9),控制反应温度625℃,在等压(p)下进行上述反应,达到平衡时乙苯的转化率为α。
①掺入水蒸气能提高乙苯的平衡转化率,其原因是___ 。
②该温度下,反应的平衡常数Kp=__ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)乙苯催化脱氢制备苯乙烯时,通常会伴随着副反应发生,其中一个反应为 (g)+H2(g)
(g)+H2(g)
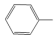 +CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
+CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
①对于该反应,下列说法正确的是____ 。
A.降低乙苯的浓度时,r减小
B.降低甲苯的浓度时,r减小
C.升高反应温度,k增大
D.达到平衡前,甲烷的生成速率逐渐增大
②设反应开始时的反应速率为r0,达到平衡之前,乙苯的转化率为α时的反应速率为r1,则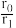 =
=___ 。
(4)含苯乙烯的废水排放会对环境造成严重污染,目前常采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2)。已知:•OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。.
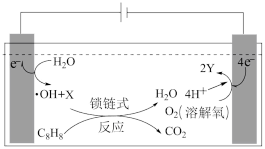
阴极反应式为____ ,X微粒的化学式为____ 。
 (g)
(g)
 (g)+H2(g) ∆H=+124kJ/mol。
(g)+H2(g) ∆H=+124kJ/mol。(1)相关物质的相对能量如表所示:
| 物质 | 乙苯(g) | H2(g) |
| 相对能量/(kJ•mol-1) | a | 0 |
(2)工业上通常在乙苯蒸气中掺入水蒸气(物质的量之比为1:9),控制反应温度625℃,在等压(p)下进行上述反应,达到平衡时乙苯的转化率为α。
①掺入水蒸气能提高乙苯的平衡转化率,其原因是
②该温度下,反应的平衡常数Kp=
(3)乙苯催化脱氢制备苯乙烯时,通常会伴随着副反应发生,其中一个反应为
 (g)+H2(g)
(g)+H2(g)
 +CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
+CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。①对于该反应,下列说法正确的是
A.降低乙苯的浓度时,r减小
B.降低甲苯的浓度时,r减小
C.升高反应温度,k增大
D.达到平衡前,甲烷的生成速率逐渐增大
②设反应开始时的反应速率为r0,达到平衡之前,乙苯的转化率为α时的反应速率为r1,则
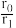 =
=(4)含苯乙烯的废水排放会对环境造成严重污染,目前常采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2)。已知:•OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。.

阴极反应式为
您最近一年使用:0次
名校
8 . 下列对图象的叙述正确的是( )
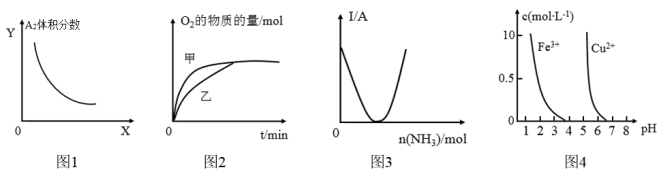

A.图1对于反应: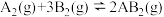 ,图①中的横轴x可以表示压强 ,图①中的横轴x可以表示压强 |
| B.图2表示其他条件相同时,甲、乙两份等浓度等体积的双氧水分解,乙中加入少量氯化铁 |
| C.图3可表示乙酸溶液中通入氨气至过量时溶液导电性的变化 |
D.图4若除去0.1mol∙L-1CuSO4溶液中的 ,可向溶液中加入适量NaOH至pH约为7 ,可向溶液中加入适量NaOH至pH约为7 |
您最近一年使用:0次
解题方法
9 . 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和催化剂的条件下,两容器中各自发生下列反应
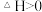 ;达到平衡时,VA=1.2aL,则下列说法不正确的是
;达到平衡时,VA=1.2aL,则下列说法不正确的是
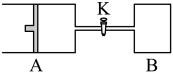

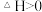 ;达到平衡时,VA=1.2aL,则下列说法不正确的是
;达到平衡时,VA=1.2aL,则下列说法不正确的是
| A.反应开始时,B容器中化学反应速率快 |
| B.A容器中X的转化率为40%,且比B容器中X的转化率大 |
| C.打开K一段时间达平衡时,A的体积为2.4aL(连通管中气体体积不计) |
| D.打开K达新平衡后,升高B容器温度,A容器体积会增大 |
您最近一年使用:0次
2021-02-07更新
|
315次组卷
|
5卷引用:【浙江新东方】高中化学20210304-010
(已下线)【浙江新东方】高中化学20210304-010浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008(已下线)期中考试模拟试题(一)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)四川省成都金苹果锦城第一中学2023-2024学年高二上学期期中考试化学试题
10 . 为减少碳氧化物的排放,工业上可回收 和
和 合成甲醇(
合成甲醇( )。
)。
(1)利用 和
和 反应合成甲醇时发生两个平行反应:
反应合成甲醇时发生两个平行反应:
反应Ⅰ
反应Ⅱ
控制 和
和 初始投料比为
初始投料比为 ,温度对
,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示:
产率的影响如图所示:
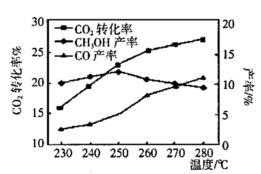
①反应Ⅰ能自发的反应条件:______ 。(填“低温”、“高温”、“任何温度”)
②由图可知温度升高 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是______ 。
③由图可知获取 最适宜的温度是
最适宜的温度是______ 。
④控制 和
和 初始投料比为
初始投料比为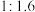 ,在
,在 时反应Ⅰ已达到平衡状态,
时反应Ⅰ已达到平衡状态, 的转化率为
的转化率为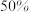 ,甲醇选择性为
,甲醇选择性为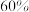 ,此时容器的体积为
,此时容器的体积为 ,若
,若 初始加入量为
初始加入量为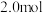 ,则反应Ⅰ的平衡常数是
,则反应Ⅰ的平衡常数是______ 。(甲醇的选择性:转化的 中生成甲醇的百分比)
中生成甲醇的百分比)
(2)利用 和
和 在一定条件下亦可合成甲醇,发生如下反应:
在一定条件下亦可合成甲醇,发生如下反应:
反应Ⅲ
其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是______ 。
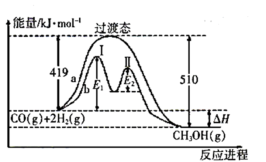
A. 上述反应的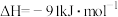
B. 反应正反应的活化能为
反应正反应的活化能为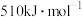
C. 过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D. 过程使用催化剂后降低了反应的活化能和
过程使用催化剂后降低了反应的活化能和
E. 过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入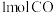 和
和 ,向乙中加入
,向乙中加入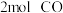 和
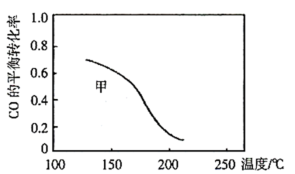
和 ,发生反应Ⅲ,测得不同温度下甲中
,发生反应Ⅲ,测得不同温度下甲中 的平衡转化率如图所示,请在图中画出不同温度下乙容器中
的平衡转化率如图所示,请在图中画出不同温度下乙容器中 的平衡转化率变化趋势的曲线
的平衡转化率变化趋势的曲线______ 。
(4)反应Ⅰ生成的甲醇常用作燃料电池的原料,请写出以甲醇、空气、氢氧化钾溶液为原料,石墨为电极构成的燃料电池的负极电极方程式______ 。
 和
和 合成甲醇(
合成甲醇( )。
)。(1)利用
 和
和 反应合成甲醇时发生两个平行反应:
反应合成甲醇时发生两个平行反应:反应Ⅰ

反应Ⅱ

控制
 和
和 初始投料比为
初始投料比为 ,温度对
,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示:
产率的影响如图所示:
①反应Ⅰ能自发的反应条件:
②由图可知温度升高
 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是③由图可知获取
 最适宜的温度是
最适宜的温度是④控制
 和
和 初始投料比为
初始投料比为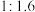 ,在
,在 时反应Ⅰ已达到平衡状态,
时反应Ⅰ已达到平衡状态, 的转化率为
的转化率为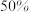 ,甲醇选择性为
,甲醇选择性为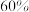 ,此时容器的体积为
,此时容器的体积为 ,若
,若 初始加入量为
初始加入量为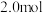 ,则反应Ⅰ的平衡常数是
,则反应Ⅰ的平衡常数是 中生成甲醇的百分比)
中生成甲醇的百分比)(2)利用
 和
和 在一定条件下亦可合成甲醇,发生如下反应:
在一定条件下亦可合成甲醇,发生如下反应:反应Ⅲ

其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是

A. 上述反应的
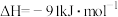
B.
 反应正反应的活化能为
反应正反应的活化能为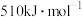
C.
 过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应D.
 过程使用催化剂后降低了反应的活化能和
过程使用催化剂后降低了反应的活化能和
E.
 过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
过程的反应速率:第Ⅱ阶段>第Ⅰ阶段(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入
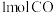 和
和 ,向乙中加入
,向乙中加入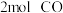 和
和 ,发生反应Ⅲ,测得不同温度下甲中
,发生反应Ⅲ,测得不同温度下甲中 的平衡转化率如图所示,请在图中画出不同温度下乙容器中
的平衡转化率如图所示,请在图中画出不同温度下乙容器中 的平衡转化率变化趋势的曲线
的平衡转化率变化趋势的曲线
(4)反应Ⅰ生成的甲醇常用作燃料电池的原料,请写出以甲醇、空气、氢氧化钾溶液为原料,石墨为电极构成的燃料电池的负极电极方程式
您最近一年使用:0次



