名校
1 . 根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
(1)表中元素,化学性质最不活泼的是_____ ,只有负价而无正价的是_____ ,氧化性最强的单质是____ ;
(2)最高价氧化物的水化物碱性最强的是_____ ,酸性最强的是_____ ,呈两性的是_____ ;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____ ;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____ ;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______ 可以验证该结论的实验是_ 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物碱性最强的是
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
2019-10-25更新
|
118次组卷
|
2卷引用:上海外国语大学附属外国语学校2017-2018学年高二12月月考化学试题
解题方法
2 . W、X、Y、Z为原子序数依次递增的短周期主族元素,W的单质是同条件下密度最小的气体,X、Y、Z为同一周期紧邻元素,M、R为同一主族的元素,M的单质常温为液态,R的单质常温为固态,且易升华。回答下列问题:
(1)写出下列元素的名称:W___ ;M____ 。
(2)若X为形成化合物种类最多的元素,XZ(YW2)2为一种有机物,是目前使用量较大的化学肥料。XZ(YW2)2在碱性条件下能被MZ−氧化成单质Q(空气中的主要成分之一),X以酸根的形式存在。
①写出Q的化学式:___ ;X、Y、Z的简单氢化物的沸点由高到低的顺序为__ (写化学式)。
②上述反应的离子方程式为___ 。
(3)若Z为本周期中半径最小的元素,其最高价氧化物对应的水化物为强酸。
①请判断R2+ZO3-→RO3-+Z2是否能发生,__ (填“能”或“不能”)发生,其原因是____ 。
②请写出R2与含YO32-溶液反应的离子方程式为____ 。
(1)写出下列元素的名称:W
(2)若X为形成化合物种类最多的元素,XZ(YW2)2为一种有机物,是目前使用量较大的化学肥料。XZ(YW2)2在碱性条件下能被MZ−氧化成单质Q(空气中的主要成分之一),X以酸根的形式存在。
①写出Q的化学式:
②上述反应的离子方程式为
(3)若Z为本周期中半径最小的元素,其最高价氧化物对应的水化物为强酸。
①请判断R2+ZO3-→RO3-+Z2是否能发生,
②请写出R2与含YO32-溶液反应的离子方程式为
您最近一年使用:0次
2019-09-26更新
|
387次组卷
|
2卷引用:学科网2019年高三11月大联考(样卷)化学试题
13-14高一·全国·课时练习
名校
解题方法
3 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________ 。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
A.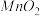 B.
B.
C. D.
D.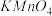
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
A.
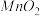 B.
B.
C.
 D.
D.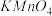
您最近一年使用:0次
2019-08-20更新
|
165次组卷
|
7卷引用:2014年高一化学人教版必修2 模块水平检测1练习卷
(已下线)2014年高一化学人教版必修2 模块水平检测1练习卷(已下线)2013-2014山东省淄博市高一下学期期末考试化学试卷2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷2015-2016学年山西省长治一中高一平行班下期中化学试卷云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题百所名校联考-必修二模块综合检测山东省泰安市新泰市第二中学2019-2020学年高一下学期期中考试化学试题
名校
4 . X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( )
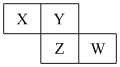

A.Y的价层电子排布式是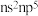 |
| B.四种元素所形成的最简单氢化物中,沸点最高的是可能Y的氢化物 |
| C.Y、Z之间可形成离子型化合物 |
| D.X、Z、W的最高价氧化物所对应的水化物不可能均是强酸 |
您最近一年使用:0次
2019-08-13更新
|
1538次组卷
|
5卷引用:新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题
5 . 下列说法正确的是
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22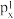 →1s22s22 →1s22s22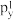 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区 |
您最近一年使用:0次
2019-07-15更新
|
2338次组卷
|
7卷引用:宁夏银川一中2018-2019学年高二下学期期末考试化学试题
名校
6 . W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
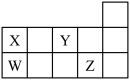

| A.四种元素中原子半径最大的为Z |
| B.四种元素最高价氧化物的水化物都是酸 |
| C.XZ4、WY2中所含化学键类型相同 |
| D.W、X形成的单质都是重要的半导体材料 |
您最近一年使用:0次
2019-06-29更新
|
740次组卷
|
5卷引用:浙江省嘉兴市2018-2019学年高一下学期期末考试化学试题
名校
7 . 下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A.原子序数W>Z>X>Y | B.纯净的X在Z2中燃烧生成XZ3 |
| C.Z的最高正价为+6 | D.HW是热稳定性最强的氢化物 |
您最近一年使用:0次
2019-06-29更新
|
456次组卷
|
2卷引用:云南省昆明市官渡区第一中学2018-2019学年高一下学期期中考试化学试题
名校
8 . 下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
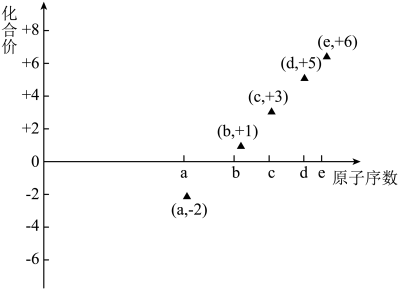

| A.31d和33d属于同种核素 |
| B.气态氢化物的稳定性:a>d>e |
| C.b、c的最高价氧化物对应水化物可以反应 |
| D.a和b形成的化合物不可能含共价键 |
您最近一年使用:0次
2019-06-26更新
|
1647次组卷
|
5卷引用:云南省昆明第一中学2018-2019学年高一下学期期中考试化学试题
名校
9 . 主族元素X、Y、Z、W的原子序数依次增大,且均小于18. X、Y、Z的原子最外层电子数之和为15;X、Z同主族;Y是地壳中含量最多的金属元素。则下列说法错误的是
| A.Y、Z、W均位于第三周期 | B.简单氢化物稳定性:X>Z |
| C.X、Y组成的化合物具有两性 | D.离子半径大小:Z>W>Y>X |
您最近一年使用:0次
2019-06-26更新
|
534次组卷
|
3卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期第三次月考化学试题
名校
解题方法
10 . 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应, 1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
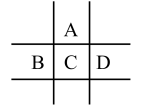
(1)A元素的名称为____________ ,D离子的结构示意图为_____________ 。
(2)C在周期表中的位置为______________________ 。
(3)元素C与元素D相比,非金属性较强的是__________ (用元素符号表示),下列表述中能证明这一事实的是________ 。(填字母序号)
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是____________ 。
(5)A、C、D、E元素形成的简单离子半径的大小顺序是________ 。(用离子符号表示)
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是________________ 。

(1)A元素的名称为
(2)C在周期表中的位置为
(3)元素C与元素D相比,非金属性较强的是
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是
(5)A、C、D、E元素形成的简单离子半径的大小顺序是
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是
您最近一年使用:0次



