名校
1 . 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易吸水,溶于水后与水反应生成碳酸氢铵和一水合氨:NH2COONH4+2H2O NH4HCO3+NH3·H2O。可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的方程式:2NH3(g)+CO2(g)
NH4HCO3+NH3·H2O。可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的方程式:2NH3(g)+CO2(g) NH2COONH4(s)ΔH<0。
NH2COONH4(s)ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是_______________ 。
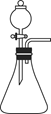
(2)制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因__________________________ 。
液体石蜡鼓泡瓶的作用是____________________________ 。
②从反应后的混合物中分离出产品的实验方法是_______________ (填写操作名称)。 为了得到干燥产品,应采取的方法是_______________ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
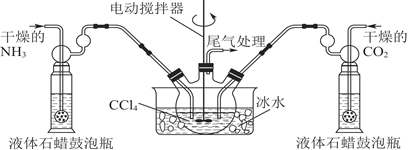
③尾气处理装置如图所示。
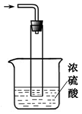
浓硫酸的作用:____________ 、________________ 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________ 。
[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
 NH4HCO3+NH3·H2O。可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的方程式:2NH3(g)+CO2(g)
NH4HCO3+NH3·H2O。可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的方程式:2NH3(g)+CO2(g) NH2COONH4(s)ΔH<0。
NH2COONH4(s)ΔH<0。(1)如图所示装置制取氨气,你所选择的试剂是

(2)制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因
液体石蜡鼓泡瓶的作用是
②从反应后的混合物中分离出产品的实验方法是
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。

浓硫酸的作用:
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为
[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
您最近一年使用:0次
2016-12-09更新
|
121次组卷
|
2卷引用:安徽省肥东县第二中学2020-2021学年高三上学期第二次月考化学试题
2 . 漂白粉的主要成分为次氯酸钙[化学式为Ca(ClO)2]和氯化钙,可用作漂白剂和作消毒剂。漂白粉中的有效成分是次氯化钙,漂白的原理是次氯化钙在空气中与CO2和H2O发生反应,生成了碳酸钙和次氯酸[HClO];次氯酸是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)次氯酸在常温下分解,反应为2HClO =2HCl+O2↑。某瓶次氯酸溶液放置一段时间后,溶液的pH __________(填“增大”或“减小”或“不变” ) 。
(2)在漂白粉中滴加盐酸,会发生复分解反应从而加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式_________。
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】 长时间放置的漂白粉是否变质?
【猜想】猜想l :该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2
猜想2:该漂白粉部分变质,固体成分为___________。
猜想3:该漂白粉全部变质,固体成分为CaC12、CaCO3。
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管等、带导管的单孔塞。
(1)次氯酸在常温下分解,反应为2HClO =2HCl+O2↑。某瓶次氯酸溶液放置一段时间后,溶液的pH __________(填“增大”或“减小”或“不变” ) 。
(2)在漂白粉中滴加盐酸,会发生复分解反应从而加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式_________。
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】 长时间放置的漂白粉是否变质?
【猜想】猜想l :该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2
猜想2:该漂白粉部分变质,固体成分为___________。
猜想3:该漂白粉全部变质,固体成分为CaC12、CaCO3。
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管等、带导管的单孔塞。
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,________________; | 有气体产生,气体使石灰水变浑浊 | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液 | 品红溶液 |
您最近一年使用:0次
名校
3 . 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s)△H<0
NH2COONH4(s)△H<0
(1)制备氨基甲酸铵的装置如图1所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。
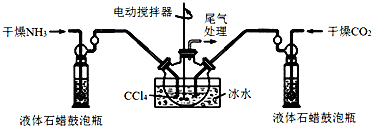
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是__________________ ,液体石蜡鼓泡瓶的作用是_____________ ;
②从反应后的混合物中分离出产品的实验方法是_____________ (填写操作名称),为了得到干燥产品,应采取的方法是_____________ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
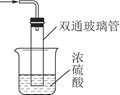
③尾气处理装置如图所示,能否将浓H2SO4改为稀H2SO4_____________ (填“能”或“否”),理由是_____ ;
(2)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g.则样品中氨基甲酸铵的质量分数为_____________ 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100].
 NH2COONH4(s)△H<0
NH2COONH4(s)△H<0(1)制备氨基甲酸铵的装置如图1所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是
②从反应后的混合物中分离出产品的实验方法是
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如图所示,能否将浓H2SO4改为稀H2SO4

(2)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g.则样品中氨基甲酸铵的质量分数为
您最近一年使用:0次
2016-12-09更新
|
294次组卷
|
2卷引用:安徽省定远重点中学2019届高三上学期第三次月考化学试题
名校
解题方法
4 . 铁的化合物在生活、生产中用途十分广泛。回答下列问题:
(1)高铁酸钠( )是一种新型绿色消毒剂,能以
)是一种新型绿色消毒剂,能以 溶液为原料,经氧化制得,步骤如下:
溶液为原料,经氧化制得,步骤如下:
i.向 溶液中加入稀硫酸酸化;
溶液中加入稀硫酸酸化;
ii.在30℃左右加入H2O2溶液搅拌;
iii.再依次向其中加入NaOH溶液、NaClO溶液;
iv.经分离可得 。
。
已知:H2O2溶液可将 氧化为
氧化为 。
。
① 中铁元素的化合价为
中铁元素的化合价为___________ ,其在处理水时既能起到杀菌消毒作用,又能起到净水作用的原因是___________ 。
②加入H2O2溶液时发生反应的离子方程式为___________ ,该步反应不能在较高温度下进行的原因是___________ 。
③加入NaOH溶液后,再加入NaClO溶液时发生反应的化学方程式为___________ ,用单线桥标出电子转移的方向和数目:___________ 。
(2)无水 (易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水
(易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水 的实验装置如图所示(E用来收集产物):
的实验装置如图所示(E用来收集产物):

①在E处收集产物是利用了
___________ 的性质。
②实验过程中若D、E之间出现堵塞,可通过___________ (填简单操作),使实验能继续进行。
③某同学用5.60g干燥铁粉制得无水 13.00g,该次实验的产率(
13.00g,该次实验的产率( )是
)是___________ 。
④无水 的作用是
的作用是___________ 。
(1)高铁酸钠(
 )是一种新型绿色消毒剂,能以
)是一种新型绿色消毒剂,能以 溶液为原料,经氧化制得,步骤如下:
溶液为原料,经氧化制得,步骤如下:i.向
 溶液中加入稀硫酸酸化;
溶液中加入稀硫酸酸化;ii.在30℃左右加入H2O2溶液搅拌;
iii.再依次向其中加入NaOH溶液、NaClO溶液;
iv.经分离可得
 。
。已知:H2O2溶液可将
 氧化为
氧化为 。
。①
 中铁元素的化合价为
中铁元素的化合价为②加入H2O2溶液时发生反应的离子方程式为
③加入NaOH溶液后,再加入NaClO溶液时发生反应的化学方程式为
(2)无水
 (易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水
(易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水 的实验装置如图所示(E用来收集产物):
的实验装置如图所示(E用来收集产物):
①在E处收集产物是利用了

②实验过程中若D、E之间出现堵塞,可通过
③某同学用5.60g干燥铁粉制得无水
 13.00g,该次实验的产率(
13.00g,该次实验的产率( )是
)是④无水
 的作用是
的作用是
您最近一年使用:0次
5 . 下列实验操作,现象或结论不正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有还原性 |
| B | 将FeSO4样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | FeSO4样品已氧化变质 |
| C | 将新制氯水和KBr溶液在试管中混合后,加入苯酚,振荡静置 | 溶液分层,下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 分别向0.1 mol•L-1酸酸和饱和硼酸溶液中滴加0.1 mol•L-1Na2CO3溶液 | 酸酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 三氯化铬是化学合成中的常见物质,三氯化铭易升华,易水解,在高温下能被氧气氧化。制备过程发生的主要反应为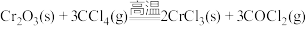 ,
,
已知: (俗称光气)有毒,遇水发生水解
(俗称光气)有毒,遇水发生水解 。
。
三氯化铬制备流程如下:
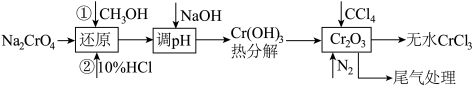
还原反应在图甲中进行,制备过程在图乙中进行。
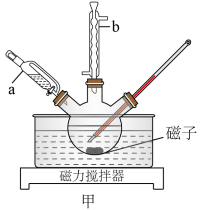

(1)图甲中仪器b的名称为_______ 。
(2)制备 时,向三颈烧瓶中通入
时,向三颈烧瓶中通入 的作用为①
的作用为①_______ ;②鼓气使反应物进入管式炉中进行反应。
(3)无水 的作用是
的作用是_______ 。
(4)装置E用来收集产物,实验过程中若D处出现堵塞,通过_______ (填操作),使实验能继续进行。
(5)G中会生成两种盐,化学式为_______ 。
(6)测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
步骤I.取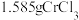 产品在强碱性条件下,加入过量的
产品在强碱性条件下,加入过量的 溶液,小火加热
溶液,小火加热 完全转化为
完全转化为 ,继续加热一段时间。
,继续加热一段时间。
步骤II.滴入适量的浓硫酸和浓磷酸,使 转化为
转化为 ,冷却后加适量的蒸馏水配成
,冷却后加适量的蒸馏水配成 溶液;
溶液;
步骤III.取 溶液,用
溶液,用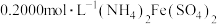 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
①步骤II中 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
②选用图中_______ (填“甲”或“乙”)盛装标准溶液 。
。
③产品中 的质量分数为
的质量分数为_______ 。
④若步骤Ⅲ中所用标准溶液已变质,将导致 质量分数测定值
质量分数测定值___ (填“偏高”、“偏低或“无影响”)。
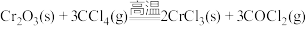 ,
,已知:
 (俗称光气)有毒,遇水发生水解
(俗称光气)有毒,遇水发生水解 。
。三氯化铬制备流程如下:

还原反应在图甲中进行,制备过程在图乙中进行。


(1)图甲中仪器b的名称为
(2)制备
 时,向三颈烧瓶中通入
时,向三颈烧瓶中通入 的作用为①
的作用为①(3)无水
 的作用是
的作用是(4)装置E用来收集产物,实验过程中若D处出现堵塞,通过
(5)G中会生成两种盐,化学式为
(6)测定产品中
 质量分数的实验步骤如下:
质量分数的实验步骤如下:步骤I.取
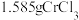 产品在强碱性条件下,加入过量的
产品在强碱性条件下,加入过量的 溶液,小火加热
溶液,小火加热 完全转化为
完全转化为 ,继续加热一段时间。
,继续加热一段时间。步骤II.滴入适量的浓硫酸和浓磷酸,使
 转化为
转化为 ,冷却后加适量的蒸馏水配成
,冷却后加适量的蒸馏水配成 溶液;
溶液;步骤III.取
 溶液,用
溶液,用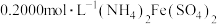 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
①步骤II中
 转化为
转化为 的离子方程式为
的离子方程式为②选用图中
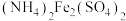 。
。③产品中
 的质量分数为
的质量分数为④若步骤Ⅲ中所用标准溶液已变质,将导致
 质量分数测定值
质量分数测定值
您最近一年使用:0次
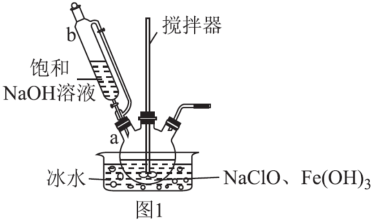
7 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
(3)用图2所示装置检验K2FeO4受热分解的产物。
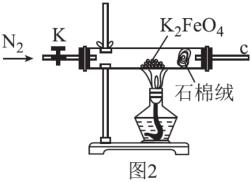
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
您最近一年使用:0次
2021-08-28更新
|
551次组卷
|
4卷引用:安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题
安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题河南部分学校2022届新高三8月份摸底联考化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题
解题方法
8 . 下列实验换作、实验现象及实验结论均正确的是
| 选项 | 实验操作: | 实验现象 | 实验结论 |
| A | 常温下,向10mL0.1mol·L-1AgNO3溶液中滴加5滴0.1mol·L-1NaCl溶液,充分反应后,再滴加5滴0.1 mol·L-1KI溶液 | 先产生白色沉淀,后变成黄色沉淀 | 说明Ksp(AgCl)> Ksp(AgI) |
| B | 向KClO3溶液中滴加AgNO3溶液 | 先产生白色沉淀 | KClO3溶液变质 |
| C | 向蔗糖溶液中加入一定量的稀硫酸加热充分水解后,再加入银氨溶液 | 没有产生银镜 | 说明蔗糖水解后的产物中不含有醛基 |
| D | 加热浸透了石蜡油的碎瓷片,将产生的气体通入酸性K2Cr2O7溶液中 | 溶液变绿色 | 石蜡油分解产生了乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
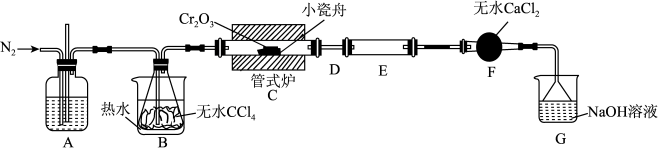
9 . 三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:① (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: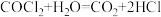 ;
;
②碱性条件下, 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
(1)A装置用于干燥 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是_______ ;无水 的作用是
的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)尾气与装置G中过量的 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是_______ 。
(4)测定产品中 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:
Ⅰ.取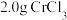 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使 转化为
转化为 。
。
Ⅲ.在溶液中加入适量浓 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液
标准溶液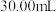 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。
①计算产品中 质量分数为
质量分数为_______ 。
②下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是_______ (填字母标号)。
A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中 溶液部分变质
溶液部分变质
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:①
 (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: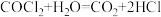 ;
;②碱性条件下,
 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。(1)A装置用于干燥
 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是 的作用是
的作用是(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是
(3)尾气与装置G中过量的
 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是(4)测定产品中
 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:Ⅰ.取
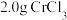 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量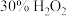 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使
 转化为
转化为 。
。Ⅲ.在溶液中加入适量浓
 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液
标准溶液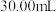 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。①计算产品中
 质量分数为
质量分数为②下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中
 溶液部分变质
溶液部分变质D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2022-03-29更新
|
663次组卷
|
3卷引用:安徽省皖南八校2022-2023学年高三上学期第一次大联考化学试题
10 . 下列操作不能达到实验目的的是
| 选项 | 实 验 目 的 | 实 验 操作 |
| A | 在溶液中将MnO4﹣完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| B | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-06-13更新
|
429次组卷
|
2卷引用:安徽省滁州市定远县第二中学2020-2021学年高一上学期第二次教学质量检测试题



