1 . “环境就是民生,青山就是美丽、蓝天也是幸福”。回答下列问题:
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是___________ 。
②某团队设计处理流程如下:
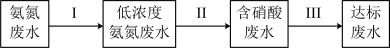
过程Ⅱ为硝化过程,在微生物的作用下实现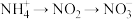 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为___________ ;
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现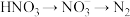 的转化,反应的化学方程式为
的转化,反应的化学方程式为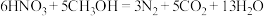 ,氧化产物是
,氧化产物是___________ ,当有1mol硝酸完全转化时,转移的电子数目为___________ 。
(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为___________ 。也可用NaClO2在酸性条件下氧化处理SO2,反应的离子方程式是___________ 。
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
引起雨水pH变化的主要原因是___________ (用化学方程式表示)。
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为___________ 。
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是②某团队设计处理流程如下:

过程Ⅱ为硝化过程,在微生物的作用下实现
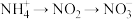 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现
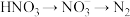 的转化,反应的化学方程式为
的转化,反应的化学方程式为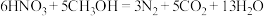 ,氧化产物是
,氧化产物是(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为
您最近一年使用:0次
名校
2 . 氯化铁是一种常用的试剂。
(1)配制一定物质的量浓度的 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是___________ 。
(2)蒸干 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是___________ (填化学式)。
(3)测定 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。
方案1:配合滴定法。
文献资料 已知:溶液中 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。
实验操作:称取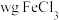 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用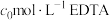 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。
①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为___________ (填字母)。
②达到滴定终点的标志是___________ 。该 样品的纯度为
样品的纯度为___________ %(用含 、V、w的代数式表示)。
、V、w的代数式表示)。
方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: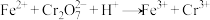 (未配平)。
(未配平)。
实验操作:称取一定量 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用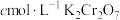 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
③应选择___________ 式滴定管盛放 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。
④上述氯化铁样品中含___________ 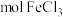 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。
⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果___________ (填“偏高”“偏低”或“无影响”)。
(1)配制一定物质的量浓度的
 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是(2)蒸干
 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是(3)测定
 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。方案1:配合滴定法。
文献资料 已知:溶液中
 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。实验操作:称取
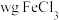 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用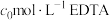 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为
②达到滴定终点的标志是
 样品的纯度为
样品的纯度为 、V、w的代数式表示)。
、V、w的代数式表示)。方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用
 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: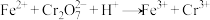 (未配平)。
(未配平)。实验操作:称取一定量
 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用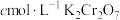 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。③应选择
 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。④上述氯化铁样品中含
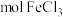 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果
您最近一年使用:0次
3 .  是锂离子电池中广泛应用的电解质。某工厂用LiF和
是锂离子电池中广泛应用的电解质。某工厂用LiF和 为原料,低温条件下反应制备
为原料,低温条件下反应制备 ,其流程如下:
,其流程如下:
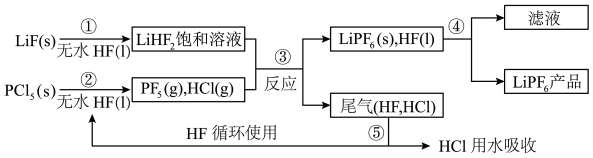
已知:HCl的沸点是−85.0℃,HF的沸点是19.5℃。
请回答下列问题:
(1)第①步反应中无水HF的作用是___________ 、___________ 。反应设备不能用玻璃材质的原因是___________ (用化学方程式表示)。
(2)该流程需在无水条件下进行,第③步反应中 极易水解,其产物为两种酸,
极易水解,其产物为两种酸, 水解的化学方程式是
水解的化学方程式是___________ 。
(3)第④步分离采用的方法是___________ 。
(4) 产品中通常混有少量LiF.取样品ng,测得Li的物质的量为wmol,则该样品中
产品中通常混有少量LiF.取样品ng,测得Li的物质的量为wmol,则该样品中 的物质的量是
的物质的量是___________ mol(用含w、n的代数式表示)。
 是锂离子电池中广泛应用的电解质。某工厂用LiF和
是锂离子电池中广泛应用的电解质。某工厂用LiF和 为原料,低温条件下反应制备
为原料,低温条件下反应制备 ,其流程如下:
,其流程如下:
已知:HCl的沸点是−85.0℃,HF的沸点是19.5℃。
请回答下列问题:
(1)第①步反应中无水HF的作用是
(2)该流程需在无水条件下进行,第③步反应中
 极易水解,其产物为两种酸,
极易水解,其产物为两种酸, 水解的化学方程式是
水解的化学方程式是(3)第④步分离采用的方法是
(4)
 产品中通常混有少量LiF.取样品ng,测得Li的物质的量为wmol,则该样品中
产品中通常混有少量LiF.取样品ng,测得Li的物质的量为wmol,则该样品中 的物质的量是
的物质的量是
您最近一年使用:0次
4 . “碳达峰·碳中和”是我国社会发展重大战略之一,研究甲烷的燃烧技术可减少CO2的排放并实现资源利用。
Ⅰ.甲烷直接燃烧可达到2800℃左右的高温,主要发生反应ⅰ,可能发生副反应ⅱ。
ⅰ.
ⅱ.
ⅲ.……
(1)利用 和
和 计算
计算 时,反应ⅲ是
时,反应ⅲ是_______ ;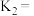
_______ (用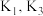 表示)。
表示)。
Ⅱ.化学链燃烧技术有利于 的捕获和综合利用。较高温度下,将恒定流速的
的捕获和综合利用。较高温度下,将恒定流速的 在
在 时刻通入反应器与载氧体
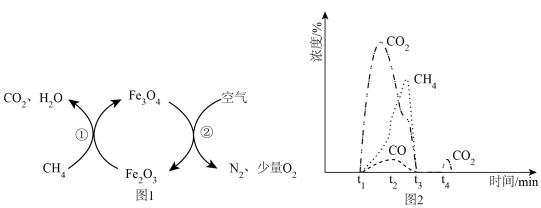
时刻通入反应器与载氧体 反应,原理如图1所示,流出气体中各组分的浓度随反应时间变化如图2所示。待反应①完成后,
反应,原理如图1所示,流出气体中各组分的浓度随反应时间变化如图2所示。待反应①完成后, 时刻向反应器中通入一段时间氩气,
时刻向反应器中通入一段时间氩气, 时刻再通入一段时间空气,发生反应②,实现载氧体的循环再生。
时刻再通入一段时间空气,发生反应②,实现载氧体的循环再生。
(2)①的化学反应方程式是_______ ,载氧体的主要作用是_______ (填“提供电子”或“接受电子”)。
(3)恒压条件下,反应①在某密闭容器中反应,平衡后通入 气,测得一段时间内
气,测得一段时间内 物质的量上升,其原因是
物质的量上升,其原因是_______ 。
(4)结合图2,依据 时刻产生
时刻产生 ,用化学方程式及简要文字解释
,用化学方程式及简要文字解释 时刻流出
时刻流出 速率突然增大的可能原因
速率突然增大的可能原因_______ 。
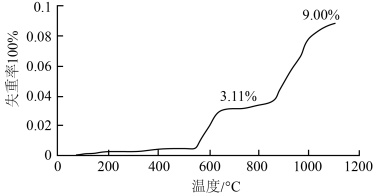
已知:失重率=
Ⅲ.某同学采用重量分析法探究载氧体的还原产物及循环效果,实验过程如下:在装置中放置一定量的 ,加热条件下通入足量
,加热条件下通入足量 ,充分均匀反应,分析固体失重率。
,充分均匀反应,分析固体失重率。
(5) 时载氧体的还原产物主要为
时载氧体的还原产物主要为 。
。结合简单计算 说明 时,载氧体的主要还原产物为
时,载氧体的主要还原产物为_______ ,依据是_______ 。
Ⅳ.有人设想利用“ ”间的转化实现
”间的转化实现 的化学链燃烧过程,按图1的呈现方式。
的化学链燃烧过程,按图1的呈现方式。
(6)将该转化关系在虚线框内画出_______ 。

Ⅰ.甲烷直接燃烧可达到2800℃左右的高温,主要发生反应ⅰ,可能发生副反应ⅱ。
ⅰ.

ⅱ.

ⅲ.……
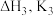
(1)利用
 和
和 计算
计算 时,反应ⅲ是
时,反应ⅲ是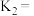
 表示)。
表示)。Ⅱ.化学链燃烧技术有利于
 的捕获和综合利用。较高温度下,将恒定流速的
的捕获和综合利用。较高温度下,将恒定流速的 在
在 时刻通入反应器与载氧体
时刻通入反应器与载氧体 反应,原理如图1所示,流出气体中各组分的浓度随反应时间变化如图2所示。待反应①完成后,
反应,原理如图1所示,流出气体中各组分的浓度随反应时间变化如图2所示。待反应①完成后, 时刻向反应器中通入一段时间氩气,
时刻向反应器中通入一段时间氩气, 时刻再通入一段时间空气,发生反应②,实现载氧体的循环再生。
时刻再通入一段时间空气,发生反应②,实现载氧体的循环再生。
(2)①的化学反应方程式是
(3)恒压条件下,反应①在某密闭容器中反应,平衡后通入
 气,测得一段时间内
气,测得一段时间内 物质的量上升,其原因是
物质的量上升,其原因是(4)结合图2,依据
 时刻产生
时刻产生 ,用化学方程式及简要文字解释
,用化学方程式及简要文字解释 时刻流出
时刻流出 速率突然增大的可能原因
速率突然增大的可能原因
已知:失重率=

Ⅲ.某同学采用重量分析法探究载氧体的还原产物及循环效果,实验过程如下:在装置中放置一定量的
 ,加热条件下通入足量
,加热条件下通入足量 ,充分均匀反应,分析固体失重率。
,充分均匀反应,分析固体失重率。(5)
 时载氧体的还原产物主要为
时载氧体的还原产物主要为 。
。 时,载氧体的主要还原产物为
时,载氧体的主要还原产物为Ⅳ.有人设想利用“
 ”间的转化实现
”间的转化实现 的化学链燃烧过程,按图1的呈现方式。
的化学链燃烧过程,按图1的呈现方式。(6)将该转化关系在虚线框内画出

您最近一年使用:0次
名校
解题方法
5 . 电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。用燃烧法确定有机物分子式常用装置如图所示。
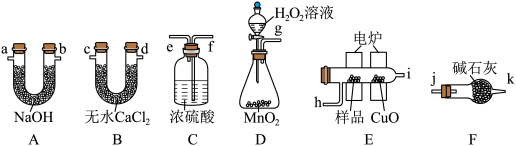
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是___________ (每个装置只能使用一次);
(2)C装置中浓硫酸的作用是___________ ;
(3)D装置中发生的化学方程式为___________ ;
(4)燃烧管中CuO的作用是___________ ,装置F中碱石灰的作用是___________ ;
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为___________ ;
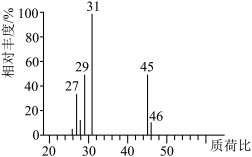
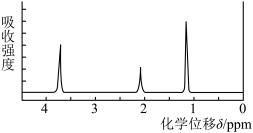
(6)用质谱仪测定其相对分子质量,得到如图所示的质谱图,则该有机物的相对分子质量___________ ;
(7)该物质的1H核磁共振氢谱图如图所示,则其结构简式为___________ 。

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是
(3)D装置中发生的化学方程式为
(4)燃烧管中CuO的作用是
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为
(6)用质谱仪测定其相对分子质量,得到如图所示的质谱图,则该有机物的相对分子质量

(7)该物质的1H核磁共振氢谱图如图所示,则其结构简式为

您最近一年使用:0次
解题方法
6 . 氯化亚铜(CuCl)微溶于水,易被氧化,广泛应用于医药等行业。以废铜渣(铜单质的质量分数为64%,CuO的质量分数为8%,其他杂质不含铜元素)为原料制备CuCl流程如下:
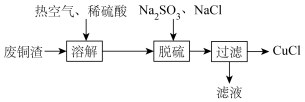
【资料】CuCl固体难溶于水,与Cl-反应生成可溶于水的离子[CuCl2]-。
(1)用Na2SO3固体配制100 mL0.50 mol/LNa2SO3溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、___________ (填仪器名称);
(2)“溶解”步骤装置如图所示。
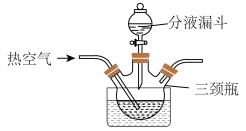
①“溶解”制备硫酸铜的化学程式为2Cu+2H2SO4+O2=2CuSO4+2H2O
___________ 。
②通入热空气的目的是___________ ;
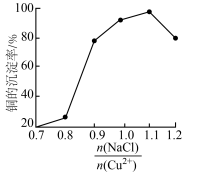
(3)“还原”过程中所得的氧化产物为___________ ,NaCl的用量对铜的沉淀率的影响如图所示。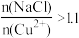 时,CuCl的沉淀率下降的原因是
时,CuCl的沉淀率下降的原因是___________ ;
(4)准确称取所制备的氯化亚铜样品0.50 g,将其置于过量的FeCl3溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20 mol/LCe(SO4)2标准溶液,至恰好反应时,消耗Ce(SO4)2标准溶液20.00 mL。(已知:FeCl3+CuCl=FeCl2+CuCl2、Ce4++Fe2+=Ce3++Fe3+,且杂质不参与反应。)
①样品中CuCl的质量分数为___________ 。(写出计算过程)
②若操作过程缺少“将洗涤液一并转移到瓶中”的步骤,会导致CuCl的质量分数___________ (填“偏大”或“偏小”)。

【资料】CuCl固体难溶于水,与Cl-反应生成可溶于水的离子[CuCl2]-。
(1)用Na2SO3固体配制100 mL0.50 mol/LNa2SO3溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、
(2)“溶解”步骤装置如图所示。

①“溶解”制备硫酸铜的化学程式为2Cu+2H2SO4+O2=2CuSO4+2H2O

②通入热空气的目的是
(3)“还原”过程中所得的氧化产物为
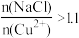 时,CuCl的沉淀率下降的原因是
时,CuCl的沉淀率下降的原因是
(4)准确称取所制备的氯化亚铜样品0.50 g,将其置于过量的FeCl3溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20 mol/LCe(SO4)2标准溶液,至恰好反应时,消耗Ce(SO4)2标准溶液20.00 mL。(已知:FeCl3+CuCl=FeCl2+CuCl2、Ce4++Fe2+=Ce3++Fe3+,且杂质不参与反应。)
①样品中CuCl的质量分数为
②若操作过程缺少“将洗涤液一并转移到瓶中”的步骤,会导致CuCl的质量分数
您最近一年使用:0次
2023-11-09更新
|
115次组卷
|
2卷引用:安徽省蚌埠市怀远禹泽学校(高中阶段)2023-2024学年高一上学期12月月考化学试卷
解题方法
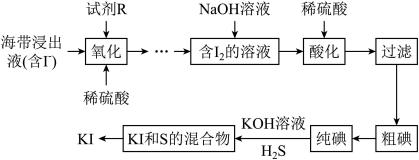
7 .  常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是___________ 。
(2)分离 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是___________ (填标号)。
(3)利用下图装置完成 与
与 反应制备
反应制备 。
。

① 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。
②三颈烧瓶中产生 的正确操作顺序为
的正确操作顺序为___________ (填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液
(4)产品纯度测定。
准确称取 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用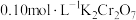 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为___________ (用含w,V的式子表示)。
 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是
(2)分离
 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是| 选项 | 试剂 | 方法 |
| a | 二硫化碳 | 分液 |
| b | 酒精 | 分液 |
| c |  溶液 溶液 | 过滤 |
(3)利用下图装置完成
 与
与 反应制备
反应制备 。
。
①
 溶液的作用是
溶液的作用是②三颈烧瓶中产生
 的正确操作顺序为
的正确操作顺序为a.旋开活塞K,通入
 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液(4)产品纯度测定。
准确称取
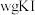 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用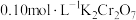 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
名校
8 . 钛在医疗领域、航空航天材料方面的使用非常广泛。某小组利用如图所示装置在实验室制备并收集 ,并用
,并用 制备纳米
制备纳米 (夹持装置略去)。
(夹持装置略去)。
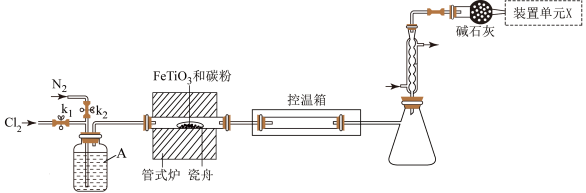
【实验一】制备无水
已知:① 高温时能与
高温时能与 反应,遇水极易水解;
反应,遇水极易水解;
②瓷舟中物质反应后除生成 、
、 外,还生成一种有毒氧化物气体和少量副产物
外,还生成一种有毒氧化物气体和少量副产物 ;
;
③相关物质的部分物理性质如表:
(1)洗气瓶A中的试剂为________ 。
(2)管式炉加热至900℃,瓷舟中主要发生的化学反应方程式为________ 。
(3)实验过程中需要先后通入 两次,第二次通入
两次,第二次通入 作用是
作用是________ 。装置单元X的作用为________ 。
(4)为除去产物中的 ,控温箱的温度应控制的范围是
,控温箱的温度应控制的范围是________ 。欲分离锥形瓶中的液态混合物,所采用的操作名称是________ 。
【实验二】用 制备纳米
制备纳米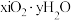
(5)可由 直接水解产生
直接水解产生 ,再经焙烧得
,再经焙烧得 。请写出
。请写出 直接水解产生
直接水解产生 的化学方程式:
的化学方程式:________ 。
(6)实验室可用电位滴定法测定纳米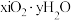 组成,方法如下:
组成,方法如下:
步骤I:取样品纳米 6.94g用稀硫酸充分溶解得到
6.94g用稀硫酸充分溶解得到 ,再用足量单质Al将
,再用足量单质Al将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入500mL容量瓶,定容得到待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入500mL容量瓶,定容得到待测液。
步骤Ⅱ:取待测液50.00mL于烧杯中,用 标准溶液滴定,将
标准溶液滴定,将 氧化为
氧化为 时,溶液中
时,溶液中 浓度不断变化,指示电极的电位发生相应变化,根据测量工作电池电动势的变化就可确定滴定终点。
浓度不断变化,指示电极的电位发生相应变化,根据测量工作电池电动势的变化就可确定滴定终点。
用 的
的 标准溶液滴定时,三次滴定消耗标准溶液的平均值为40.00mL。通过计算,该样品的组成为
标准溶液滴定时,三次滴定消耗标准溶液的平均值为40.00mL。通过计算,该样品的组成为________ 。
 ,并用
,并用 制备纳米
制备纳米 (夹持装置略去)。
(夹持装置略去)。
【实验一】制备无水

已知:①
 高温时能与
高温时能与 反应,遇水极易水解;
反应,遇水极易水解;②瓷舟中物质反应后除生成
 、
、 外,还生成一种有毒氧化物气体和少量副产物
外,还生成一种有毒氧化物气体和少量副产物 ;
;③相关物质的部分物理性质如表:
熔点/℃ | 沸点/℃ | 水溶性 | |
| -23.2 | 136.4 | 极易水解生成白色沉淀,能溶于 |
| 306 | 315 | 易水解生成红褐色沉淀 |
| -23 | 76.8 | 难溶于水 |
(2)管式炉加热至900℃,瓷舟中主要发生的化学反应方程式为
(3)实验过程中需要先后通入
 两次,第二次通入
两次,第二次通入 作用是
作用是(4)为除去产物中的
 ,控温箱的温度应控制的范围是
,控温箱的温度应控制的范围是【实验二】用
 制备纳米
制备纳米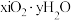
(5)可由
 直接水解产生
直接水解产生 ,再经焙烧得
,再经焙烧得 。请写出
。请写出 直接水解产生
直接水解产生 的化学方程式:
的化学方程式:(6)实验室可用电位滴定法测定纳米
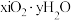 组成,方法如下:
组成,方法如下:步骤I:取样品纳米
 6.94g用稀硫酸充分溶解得到
6.94g用稀硫酸充分溶解得到 ,再用足量单质Al将
,再用足量单质Al将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入500mL容量瓶,定容得到待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入500mL容量瓶,定容得到待测液。步骤Ⅱ:取待测液50.00mL于烧杯中,用
 标准溶液滴定,将
标准溶液滴定,将 氧化为
氧化为 时,溶液中
时,溶液中 浓度不断变化,指示电极的电位发生相应变化,根据测量工作电池电动势的变化就可确定滴定终点。
浓度不断变化,指示电极的电位发生相应变化,根据测量工作电池电动势的变化就可确定滴定终点。用
 的
的 标准溶液滴定时,三次滴定消耗标准溶液的平均值为40.00mL。通过计算,该样品的组成为
标准溶液滴定时,三次滴定消耗标准溶液的平均值为40.00mL。通过计算,该样品的组成为
您最近一年使用:0次
2023-05-29更新
|
487次组卷
|
3卷引用:安徽六校教育研究会2024届高三上学期入学素质测试化学试题
名校
9 . 菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行了探究。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙( )
)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】
(1) “菠菜豆腐不能同食”的原因可能是___________ 。
【探究一】菠菜中部分成分分析
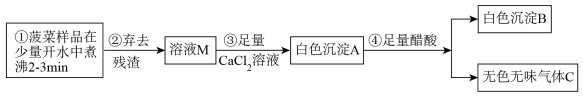
(2)步骤③中加入足量的 溶液的目的
溶液的目的___________ 。
(3)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式___________ 。
(4)白色沉淀B的化学式为___________ ,由此可见菠菜豆腐不能同食。以下饮食观点正确的是___________ 。(填字母)
A.禁吃菠菜 B.高钙牛奶可与菠菜同食 C.菠菜烹饪时可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体( )热分解研究。
)热分解研究。
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)

(5)①反应开始前通入氮气的目的是___________ 。
②装置B中硫酸铜粉未变蓝,说明产物中有___________ ,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物还有___________ 和___________ ,经检验A中残留固体为氧化物。
③对上述装置从环保角度提一个改进建议___________ 。
(6)某研究所利用SDT Q600热分析仪对草酸钙晶体( )进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图。
)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为___________ 。
②计算 中的x
中的x___________ 。
③残留固体为 时的温度范围
时的温度范围___________ ,写出固体质量由12.8g变为10.0g时的化学方程式___________ 。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(
 )
)③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】
(1) “菠菜豆腐不能同食”的原因可能是
【探究一】菠菜中部分成分分析

(2)步骤③中加入足量的
 溶液的目的
溶液的目的(3)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式
(4)白色沉淀B的化学式为
A.禁吃菠菜 B.高钙牛奶可与菠菜同食 C.菠菜烹饪时可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(
 )热分解研究。
)热分解研究。按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)

(5)①反应开始前通入氮气的目的是
②装置B中硫酸铜粉未变蓝,说明产物中有
③对上述装置从环保角度提一个改进建议
(6)某研究所利用SDT Q600热分析仪对草酸钙晶体(
 )进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图。
)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图。
①800℃以上时,固体成分的化学式为
②计算
 中的x
中的x③残留固体为
 时的温度范围
时的温度范围
您最近一年使用:0次
2023-05-26更新
|
84次组卷
|
3卷引用:安徽师范大学附属中学2022-2023学年高一上学期自主招生考试化学试题
安徽师范大学附属中学2022-2023学年高一上学期自主招生考试化学试题(已下线)云南师范大学附属中学2023-2024学年高一上学期开学考试化学试题云南师范大学附属中学2023-2024学年高一上学期开学考试化学试题
解题方法
10 . I.氯化铁可用于金属蚀刻,污水处理。
(1)把FeCl3溶液蒸干灼烧得到的主要产物是_______ 。
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法正确的是_______ (填序号)。
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x>y>z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大。
II.滴定实验是化学学科中最重要的定量实验之一、葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
(3)滴定时,I2溶液应装在_______ (“酸”或“碱”)式滴定管中,以淀粉作指示剂,则滴定终点的现象为_______ 。
(4)实验消耗标准I2溶液50.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为_______ g·L-1。
(5)下列情形会造成测定结果偏高的是_______(填序号)。
(1)把FeCl3溶液蒸干灼烧得到的主要产物是
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
| 实验 | c(FeCl3)/mol·L−1 | V(FeCl3)/mL | 温度/℃ | pH |
| 1 | 0.1 | 5 | 25 | x |
| 2 | 0.1 | 5 | 35 | y |
| 3 | 0.2 | 5 | 25 | z |
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x>y>z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大。
II.滴定实验是化学学科中最重要的定量实验之一、葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
(3)滴定时,I2溶液应装在
(4)实验消耗标准I2溶液50.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为
(5)下列情形会造成测定结果偏高的是_______(填序号)。
| A.滴定持续时间稍长,溶液中部分HI被空气氧化 |
| B.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗 |
| C.滴定前平视,滴定后俯视 |
| D.滴定前滴定管尖嘴有气泡滴定后气泡消失 |
您最近一年使用:0次



