名校
解题方法
1 . 金属的冶炼体现了人类文明的发展水平。下列有关金属冶炼的说法不正确的是
A.工业上用焦炭还原 制取密度小、耐腐蚀的金属铝 制取密度小、耐腐蚀的金属铝 |
| B.金属被人类开发利用的先后顺序主要取决于金属的活动性,不是在地壳中的含量 |
| C.金属的冶炼是将金属元素由化合态还原为游离态 |
| D.金属Mg、Na工业上都是用电解熔融氯化物的方法冶炼 |
您最近一年使用:0次
名校
2 . 完成下列问题。
(1)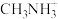 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角___________ (填“大”或“小”)。
(2)正硝酸钠( )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。
① 阴离子的空间构型为
阴离子的空间构型为___________ ,其中心原子杂化方式为___________ 。
②写出一种与 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子___________ (填化学式)。
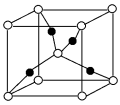
(3)①一个Cu2O晶胞(见图)中,Cu原子的数目为___________ 。
②Cu2O晶胞参数为anm,摩尔质量为M,求Cu2O的密度___________ g/cm3(只列出计算表达式)
(1)
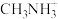 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角(2)正硝酸钠(
 )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。①
 阴离子的空间构型为
阴离子的空间构型为②写出一种与
 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子(3)①一个Cu2O晶胞(见图)中,Cu原子的数目为
②Cu2O晶胞参数为anm,摩尔质量为M,求Cu2O的密度
您最近一年使用:0次
3 . 碘化亚铁(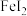 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)___________ ,若无此装置,写出铁粉参与的副反应的化学方程式:___________ 。
(2)硬质玻璃管直接接入收集器而不用导管的原因是___________ ,收集器浸泡在冷水中的原因是___________ 。
(3)试剂a的作用是___________ 。
(4)已知氧化性: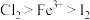 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:___________ 。
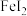 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)
(2)硬质玻璃管直接接入收集器而不用导管的原因是
(3)试剂a的作用是
(4)已知氧化性:
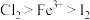 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:
您最近一年使用:0次
名校
4 . 草酸亚铁晶体( )是常用的分析试剂,可通过
)是常用的分析试剂,可通过 [硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题
[硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题
实验步骤:(连接好装置后)
(i)……;
(ii)加入试剂;
(iii)打开d、c,加热,通入氨气制得硫酸铵;
(iv)……(a、b止水夹“操作1”),加入稀硫酸,产生 ,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;
,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;
(v)将B中溶液倒入蒸发皿中,经系列操作得到硫酸亚铁铵。
(1)操作(i)为_______ 。
(2)操作(iv)产生H2,赶出装置内的空气的目的为_______ ;a、b止水夹“操作2”为_______ 。
(3)用离子方程式表示装置B在操作(iii)时发生的反应_______ ;装置B中存在一处缺陷为_______ 。
Ⅱ.制备草酸亚铁晶体并测定其组成。
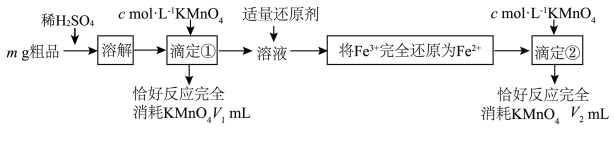
将制得的硫酸亚铁铵与草酸在一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体粗品。该草酸亚铁晶体 粗品中可能含有的杂质为
粗品中可能含有的杂质为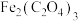 、
、 ,采用
,采用 溶液滴定法测定该粗品的组成,实验过程如下图。
溶液滴定法测定该粗品的组成,实验过程如下图。
已知:草酸为弱酸,可被 溶液氧化为
溶液氧化为 。
。 ,还有
,还有_______ 。
(5)样品中所含 (摩尔质量为
(摩尔质量为 )的质量分数表达式
)的质量分数表达式_______ 。
 )是常用的分析试剂,可通过
)是常用的分析试剂,可通过 [硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题
[硫酸亚铁铵晶体,易氧化]与草酸反应制得。制备并测定草酸亚铁晶体组成的实验设计如下,回答下列问题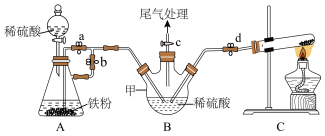
实验步骤:(连接好装置后)
(i)……;
(ii)加入试剂;
(iii)打开d、c,加热,通入氨气制得硫酸铵;
(iv)……(a、b止水夹“操作1”),加入稀硫酸,产生
 ,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;
,赶出装置内的空气,……(a、b止水夹“操作2”),将A中的硫酸亚铁压入到B中;(v)将B中溶液倒入蒸发皿中,经系列操作得到硫酸亚铁铵。
(1)操作(i)为
(2)操作(iv)产生H2,赶出装置内的空气的目的为
(3)用离子方程式表示装置B在操作(iii)时发生的反应
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸在一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体粗品。该草酸亚铁晶体
 粗品中可能含有的杂质为
粗品中可能含有的杂质为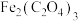 、
、 ,采用
,采用 溶液滴定法测定该粗品的组成,实验过程如下图。
溶液滴定法测定该粗品的组成,实验过程如下图。已知:草酸为弱酸,可被
 溶液氧化为
溶液氧化为 。
。
 ,还有
,还有(5)样品中所含
 (摩尔质量为
(摩尔质量为 )的质量分数表达式
)的质量分数表达式
您最近一年使用:0次
名校
5 . 硼、氮、铁、钴、镍等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
(2)硼酸( )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在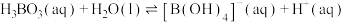 的平衡,回答下列问题。
的平衡,回答下列问题。__________ 。
②下列关于硼酸的说法正确的是__________ (填序号)。
a. 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
c.硼酸分子的稳定性与氢键有关 d. 晶体中有
晶体中有 氢键
氢键
(3)叠氮化合物在化工上有重要应用, 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式__________ (写出一种即可),其立体构型为__________ 。
(4) 的结构如图所示,
的结构如图所示, 中
中 、
、 、
、 由大到小的顺序是
由大到小的顺序是____________________ 。 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于__________ 位置。
①从该晶胞中能分割出来的结构图有_______ (填标号)。 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有__________ 个,该距离为__________ pm(仅列式不计算)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
A.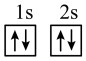 | B. |
C.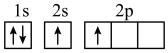 | D.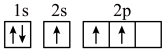 |
(2)硼酸(
 )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在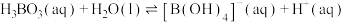 的平衡,回答下列问题。
的平衡,回答下列问题。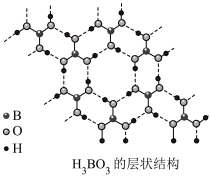
②下列关于硼酸的说法正确的是
a.
 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制c.硼酸分子的稳定性与氢键有关 d.
 晶体中有
晶体中有 氢键
氢键(3)叠氮化合物在化工上有重要应用,
 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式(4)
 的结构如图所示,
的结构如图所示, 中
中 、
、 、
、 由大到小的顺序是
由大到小的顺序是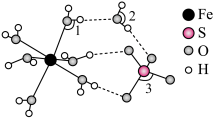
 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于
①从该晶胞中能分割出来的结构图有
a.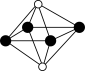 b.
b.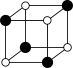 c.
c.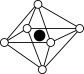 d.
d. e.
e.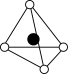
 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
您最近一年使用:0次
名校
解题方法
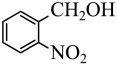
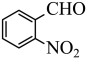
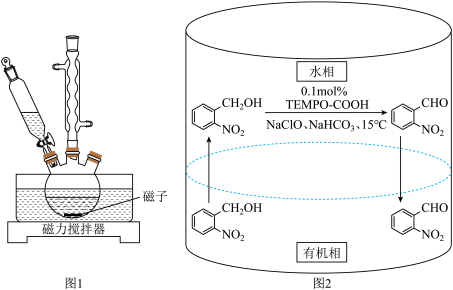
6 . 实验室以邻硝基苄醇为原料,通过图1装置(夹持仪器已略去)利用两相反应体系(图2)在TEMPO-COOH水溶液做催化剂下实现选择性氧化合成邻硝基苯甲醛。部分物质的性质如下表所示。
Ⅱ.反应完全后,将反应液倒入分液漏斗,分出有机层后,水相用10.0mL二氯甲烷萃取,合并有机相,经无水硫酸钠干燥、过滤后,除去并回收滤液中的二氯甲烷,得到粗品。
Ⅲ.将粗品溶解在20.0mL二氯甲烷中,加入10.0mL饱和NaHSO3溶液,充分作用后,分离得到水层,水层在冰浴中用5%氢氧化钠溶液调节pH到10,浅黄色固体析出完全。抽滤、干燥至恒重,得1.30g产品。
(1)控制反应温度为15℃的方法是___________ ;滴加NaC1O溶液时,需要先将漏斗上端玻璃塞打开,目的是___________ 。
(2)合成产品的化学方程式为___________ 。
(3)配制饱和NaHCO3溶液时,必须使用的仪器是(填写仪器名称)___________ 。____________ ,该副产物主要成分是___________ 。
(5)步骤Ⅱ中除去并回收二氯甲烷的实验方法是___________ 。
(6)本实验产率为___________ (计算结果保留3位有效数字)。
| 物质 |
|
| TEMPO-COOH |
| 溶解性 | 微溶于水,易溶于CH2Cl2 | 难溶于水,易溶于CH2Cl2 | 易溶于水,难溶于CH2Cl2 |
| 熔点/℃ | 70 | 43 | —— |
| 沸点/℃ | 270 | 153 | —— |
已知: 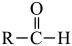 +NaHSO3
+NaHSO3
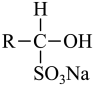 (易溶于水);
(易溶于水);
Ⅱ.反应完全后,将反应液倒入分液漏斗,分出有机层后,水相用10.0mL二氯甲烷萃取,合并有机相,经无水硫酸钠干燥、过滤后,除去并回收滤液中的二氯甲烷,得到粗品。
Ⅲ.将粗品溶解在20.0mL二氯甲烷中,加入10.0mL饱和NaHSO3溶液,充分作用后,分离得到水层,水层在冰浴中用5%氢氧化钠溶液调节pH到10,浅黄色固体析出完全。抽滤、干燥至恒重,得1.30g产品。
(1)控制反应温度为15℃的方法是
(2)合成产品的化学方程式为
(3)配制饱和NaHCO3溶液时,必须使用的仪器是(填写仪器名称)
(5)步骤Ⅱ中除去并回收二氯甲烷的实验方法是
(6)本实验产率为
您最近一年使用:0次
名校
7 . 按要求回答下列各题:
(1)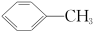 的一溴代物有
的一溴代物有___________ 种。
(2)茅苍术醇(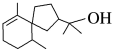 )的分子式为
)的分子式为_________ ,所含官能团名称为_________ 。
(3)用系统命名法命名物质 :
:___________ ;
(4)环癸五烯分子结构可表示为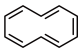 。环癸五烯具有的性质有
。环癸五烯具有的性质有___________ 。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)写出 的一种同分异构体的结构简式:
的一种同分异构体的结构简式:___________ 。
(6)某物质只含 、
、 、
、 三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)___________ 。
②下列物质中,与该物质互为同分异构体的是___________ (填字母)。
A.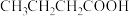 B.
B.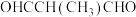
C.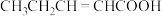 D.
D.
③该分子中共平面的原子个数最多为___________ 个(已知羧基的四个原子可以共平面)。
④该物质与 反应的化学方程式为
反应的化学方程式为___________ 。
(1)
 的一溴代物有
的一溴代物有(2)茅苍术醇(
 )的分子式为
)的分子式为(3)用系统命名法命名物质
 :
:(4)环癸五烯分子结构可表示为
 。环癸五烯具有的性质有
。环癸五烯具有的性质有a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)写出
 的一种同分异构体的结构简式:
的一种同分异构体的结构简式:(6)某物质只含
 、
、 、
、 三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
②下列物质中,与该物质互为同分异构体的是
A.
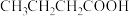 B.
B.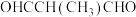
C.
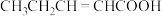 D.
D.
③该分子中共平面的原子个数最多为
④该物质与
 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
名校
8 . 单质硼、硼酸( )、硼砂(
)、硼砂( )中阴离子
)中阴离子 的结构或结构单元分别如图1、图2、图3所示。
的结构或结构单元分别如图1、图2、图3所示。
(1)图1为某晶体硼的部分结构单元,其熔点为 ,属于
,属于___________ 晶体,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为___________ 。
(2)图2为硼酸晶体的平面结构,硼酸晶体中存在的作用力有___________ (填标号)
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3) 与
与 溶液反应时,反应方程式为
溶液反应时,反应方程式为 ,则
,则 是
是___________ 弱酸(填“一元”或“三元”);当 过量时,反应得到硼砂晶体,其化学方程式为
过量时,反应得到硼砂晶体,其化学方程式为 ,硼砂阴离子
,硼砂阴离子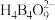 的结构如图3所示,其中
的结构如图3所示,其中 原子的杂化方式为
原子的杂化方式为___________ 。
(4)B、Al,Ga为同主族元素, ,
, 在一定条件下均易形成双聚分子,而
在一定条件下均易形成双聚分子,而 却很难形成双聚分子,其主要原因是
却很难形成双聚分子,其主要原因是 分子内形成了大
分子内形成了大 键,该大
键,该大 键可表示为
键可表示为___________ 。(分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数)
键的电子数)
 )、硼砂(
)、硼砂( )中阴离子
)中阴离子 的结构或结构单元分别如图1、图2、图3所示。
的结构或结构单元分别如图1、图2、图3所示。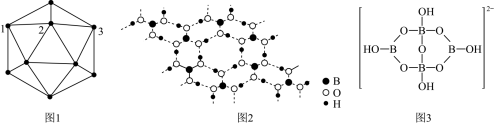
(1)图1为某晶体硼的部分结构单元,其熔点为
 ,属于
,属于(2)图2为硼酸晶体的平面结构,硼酸晶体中存在的作用力有
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)
 与
与 溶液反应时,反应方程式为
溶液反应时,反应方程式为 ,则
,则 是
是 过量时,反应得到硼砂晶体,其化学方程式为
过量时,反应得到硼砂晶体,其化学方程式为 ,硼砂阴离子
,硼砂阴离子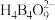 的结构如图3所示,其中
的结构如图3所示,其中 原子的杂化方式为
原子的杂化方式为(4)B、Al,Ga为同主族元素,
 ,
, 在一定条件下均易形成双聚分子,而
在一定条件下均易形成双聚分子,而 却很难形成双聚分子,其主要原因是
却很难形成双聚分子,其主要原因是 分子内形成了大
分子内形成了大 键,该大
键,该大 键可表示为
键可表示为 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大
代表参与形成大 键的原子数,
键的原子数, 代表参与形成大
代表参与形成大 键的电子数)
键的电子数)
您最近一年使用:0次
名校
9 . A、B、M是生活中最常见的前四周期金属元素,A元素的单质既可与强酸反应也可与强碱反应,B位于周期表的第八纵行,其+3价离子比+2价离子在水溶液中稳定,M原子的价电子排布为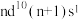 。回答下列问题:
。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为___________ 。
(2)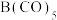 为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。
为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。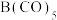 更接近于
更接近于___________ (填晶体类型)。下列说法错误的是___________ (填标号)。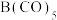 中B的化合价为0
中B的化合价为0
B.配体与B原子所形成的配位键的键能相同
C.B在周期表中位于VIII族,属于d区元素
D.制备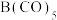 应在隔绝空气的条件下进行
应在隔绝空气的条件下进行
(3) 中存在的
中存在的 键有
键有___________ mol。 具有对称的空间结构,其中2个
具有对称的空间结构,其中2个 分别被
分别被 取代能得到两种不同结构的
取代能得到两种不同结构的 ,则
,则 中由4个
中由4个 围成的图形是
围成的图形是___________ 。
(4)金属A与M可形成多种组成不同的合金,其中一种合金的晶胞如图甲所示(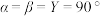 ),图乙为晶胞在z轴方向的投影。
),图乙为晶胞在z轴方向的投影。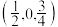 ,则b点原子的分数坐标为
,则b点原子的分数坐标为___________ 。
②该晶体的密度为___________  (用含NA的计算式回答)。
(用含NA的计算式回答)。
(5) 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为___________ 。
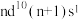 。回答下列问题:
。回答下列问题:(1)
 的价电子排布式为
的价电子排布式为(2)
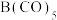 为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。
为黄色粘稠状液体,60℃在空气中可自燃,其结构和部分键长如图所示。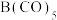 更接近于
更接近于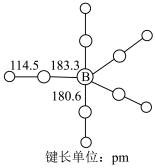
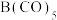 中B的化合价为0
中B的化合价为0B.配体与B原子所形成的配位键的键能相同
C.B在周期表中位于VIII族,属于d区元素
D.制备
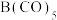 应在隔绝空气的条件下进行
应在隔绝空气的条件下进行(3)
 中存在的
中存在的 键有
键有 具有对称的空间结构,其中2个
具有对称的空间结构,其中2个 分别被
分别被 取代能得到两种不同结构的
取代能得到两种不同结构的 ,则
,则 中由4个
中由4个 围成的图形是
围成的图形是(4)金属A与M可形成多种组成不同的合金,其中一种合金的晶胞如图甲所示(
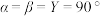 ),图乙为晶胞在z轴方向的投影。
),图乙为晶胞在z轴方向的投影。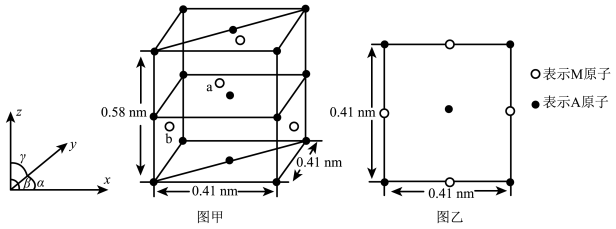
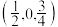 ,则b点原子的分数坐标为
,则b点原子的分数坐标为②该晶体的密度为
 (用含NA的计算式回答)。
(用含NA的计算式回答)。(5)
 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
形成配位数为6的配合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,则该配合物的化学式为
您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分,其中所列数字分别代表某一元素
(1)表中属于d区的元素是___________ (填编号)。
(2)⑤⑥⑦三种元素中电负性最大的是___________ (填写元素符号),在第二周期中第一电离能介于②和③之间的元素有___________ 种。
(3)元素⑨在周期表中的位置___________ 。
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为___________ 。
(5)⑥和⑦相比较,非金属性较弱的是___________ (填元素符号),可以验证你的结论的是下列中的___________ (填编号)。
A.气态氢化物的稳定性 B.两元素的电负性 C.含氧酸的酸性 D.最高化合价
(6)①与③的元素形成的10电子中性分子X的空间构型为___________ ,它极易溶于水中,请简要说明该物质易溶于水的原因___________ 。

(1)表中属于d区的元素是
(2)⑤⑥⑦三种元素中电负性最大的是
(3)元素⑨在周期表中的位置
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为
(5)⑥和⑦相比较,非金属性较弱的是
A.气态氢化物的稳定性 B.两元素的电负性 C.含氧酸的酸性 D.最高化合价
(6)①与③的元素形成的10电子中性分子X的空间构型为
您最近一年使用:0次