1 . 乙二胺( ,简写为R)是一种二元弱碱。
,简写为R)是一种二元弱碱。 时,向
时,向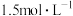 乙二胺溶液中通入
乙二胺溶液中通入 气体,所得溶液的
气体,所得溶液的 与体系中含
与体系中含 微粒浓度的对数值
微粒浓度的对数值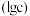 、反应物的物质的量之比
、反应物的物质的量之比 关系如图所示。下列有关说法正确的是
关系如图所示。下列有关说法正确的是
 ,简写为R)是一种二元弱碱。
,简写为R)是一种二元弱碱。 时,向
时,向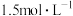 乙二胺溶液中通入
乙二胺溶液中通入 气体,所得溶液的
气体,所得溶液的 与体系中含
与体系中含 微粒浓度的对数值
微粒浓度的对数值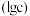 、反应物的物质的量之比
、反应物的物质的量之比 关系如图所示。下列有关说法正确的是
关系如图所示。下列有关说法正确的是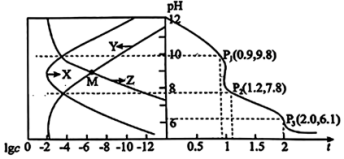
A.曲线 表示 表示 |
B.乙二胺的电离平衡常数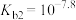 |
C. 点对应溶液的 点对应溶液的 |
D. 对应的溶液中 对应的溶液中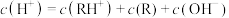 |
您最近一年使用:0次
2 . 一种由 @石墨烯
@石墨烯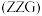 电极与涂覆
电极与涂覆 的镍基电极组成的可充放电电池,其原料利用率高,寿命长,充电原理如图所示。下列说法错误的是
的镍基电极组成的可充放电电池,其原料利用率高,寿命长,充电原理如图所示。下列说法错误的是
 @石墨烯
@石墨烯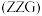 电极与涂覆
电极与涂覆 的镍基电极组成的可充放电电池,其原料利用率高,寿命长,充电原理如图所示。下列说法错误的是
的镍基电极组成的可充放电电池,其原料利用率高,寿命长,充电原理如图所示。下列说法错误的是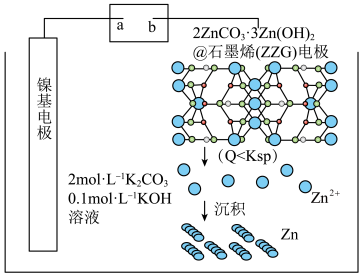
A.充电时,电流的方向: 镍基电极 镍基电极 ZZG电极 ZZG电极 |
B.充电时,阴极附近电解液 增大 增大 |
C.放电时,镍基电极的反应: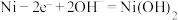 |
D.放电时,理论上外电路有 电子通过时, 电子通过时, 电极上析出 电极上析出 固体 固体 |
您最近一年使用:0次
解题方法
3 . 四元半导体化合物CZTS的四方晶胞如图所示,已知晶胞参数为 ,
, ,
, ,X原子的坐标为
,X原子的坐标为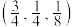 ,设
,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 ,
, ,
, ,X原子的坐标为
,X原子的坐标为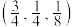 ,设
,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是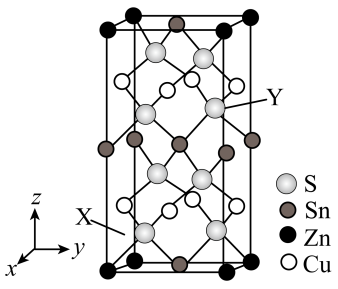
A.该物质化学式为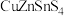 | B. 位于第4周期ⅥA族 位于第4周期ⅥA族 |
C. 原子的坐标为 原子的坐标为 | D.晶体密度为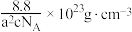 |
您最近一年使用:0次
解题方法
4 . 常温下,用0.1  NaOH溶液滴定20mL 0.1
NaOH溶液滴定20mL 0.1 醋酸(HAc)溶液,溶液中HAc、
醋酸(HAc)溶液,溶液中HAc、 的分布系数
的分布系数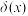 [如
[如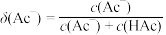 ]、pH的变化与V(NaOH)关系如图所示。滴定过程形成具有缓冲能力(外加少量酸或碱时,溶液pH变化不明显)的溶液,已知缓冲能力越强,缓冲容量β的值越大。下列有关说法正确的是
]、pH的变化与V(NaOH)关系如图所示。滴定过程形成具有缓冲能力(外加少量酸或碱时,溶液pH变化不明显)的溶液,已知缓冲能力越强,缓冲容量β的值越大。下列有关说法正确的是
 NaOH溶液滴定20mL 0.1
NaOH溶液滴定20mL 0.1 醋酸(HAc)溶液,溶液中HAc、
醋酸(HAc)溶液,溶液中HAc、 的分布系数
的分布系数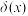 [如
[如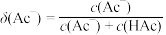 ]、pH的变化与V(NaOH)关系如图所示。滴定过程形成具有缓冲能力(外加少量酸或碱时,溶液pH变化不明显)的溶液,已知缓冲能力越强,缓冲容量β的值越大。下列有关说法正确的是
]、pH的变化与V(NaOH)关系如图所示。滴定过程形成具有缓冲能力(外加少量酸或碱时,溶液pH变化不明显)的溶液,已知缓冲能力越强,缓冲容量β的值越大。下列有关说法正确的是
| A.β(b)<β(c) |
B. 约为 约为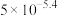 |
C.b点: |
| D.若改用与NaOH等浓度的氨水滴定,则反应终点由c点向d点方向移动 |
您最近一年使用:0次
5 . 水系锌碘电池极具潜力,工作原理如图所示。基于壳聚糖(CTS)形成的双螺旋结构的功能粘结剂,能有效抑制电池工作时产生的 扩散,防止电池寿命快速衰减。下列说法正确的是
扩散,防止电池寿命快速衰减。下列说法正确的是
 扩散,防止电池寿命快速衰减。下列说法正确的是
扩散,防止电池寿命快速衰减。下列说法正确的是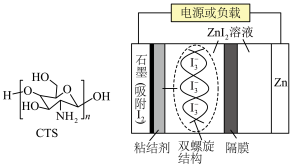
| A.CTS通过范德华力形成双螺旋结构 |
| B.充电时,Zn电极接电源负极,发生氧化反应 |
| C.放电时,外电路转移0.2 mol电子,负极区溶液质量增加6.5g |
D.充电时,阳极区发生的反应有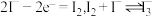 |
您最近一年使用:0次
6 . 我国力争2060年实现碳中和。 催化还原
催化还原 为减少
为减少 的排放提供良好的解决方案。涉及的主要反应有:
的排放提供良好的解决方案。涉及的主要反应有:
反应I: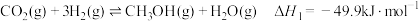
反应Ⅱ: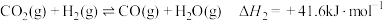
(1)已知下列物质的标准摩尔生成焓:
则甲醇燃烧的热化学方程式为___________ 。
(2)一定温度下,将 和
和 按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。
按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。
①关于该平衡体系的说法正确的是___________ (填标号)。
A.体系中各物质的浓度相等
B.降低温度,反应I和Ⅱ的速率都减小。
C.缩小容器体积,反应I和Ⅱ重新达到平衡的时间相同
D.恒温恒压下充入Ar,可提高 的选择性
的选择性
②若容器体积不变,初始压强为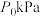 ,测得平衡时
,测得平衡时 的分压为
的分压为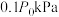 ,
, 的转化率为25%。从反应开始到平衡
的转化率为25%。从反应开始到平衡 的平均反应速率为
的平均反应速率为___________  (用分压表示)。反应Ⅱ的平衡常数
(用分压表示)。反应Ⅱ的平衡常数
___________ 。
(3)350℃、恒容条件下,只发生反应I,测得平衡体系中 的体积分数(
的体积分数( )与x[
)与x[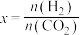 ,
,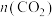 和
和 为初始的物质的量]的关系如图1所示。图中a、b、c、d四点
为初始的物质的量]的关系如图1所示。图中a、b、c、d四点 转化率最高的是
转化率最高的是___________ (填标号),理由是___________ 。b点对应的
___________ 。___________ 空隙中。该合金每个晶胞可以储存4个氢分子,则 的合金储存氢气的物质的量为
的合金储存氢气的物质的量为___________ mol(阿伏加德罗常数的值为 )。
)。
 催化还原
催化还原 为减少
为减少 的排放提供良好的解决方案。涉及的主要反应有:
的排放提供良好的解决方案。涉及的主要反应有:反应I:
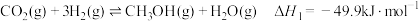
反应Ⅱ:
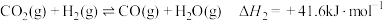
(1)已知下列物质的标准摩尔生成焓:
| 物质 |  |  |  |  |
标准摩尔生成焓 | 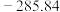 |  | 0 | 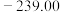 |
(2)一定温度下,将
 和
和 按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。
按物质的量之比1:4混合充入密闭容器中,10min后达到平衡。①关于该平衡体系的说法正确的是
A.体系中各物质的浓度相等
B.降低温度,反应I和Ⅱ的速率都减小。
C.缩小容器体积,反应I和Ⅱ重新达到平衡的时间相同
D.恒温恒压下充入Ar,可提高
 的选择性
的选择性②若容器体积不变,初始压强为
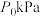 ,测得平衡时
,测得平衡时 的分压为
的分压为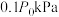 ,
, 的转化率为25%。从反应开始到平衡
的转化率为25%。从反应开始到平衡 的平均反应速率为
的平均反应速率为 (用分压表示)。反应Ⅱ的平衡常数
(用分压表示)。反应Ⅱ的平衡常数
(3)350℃、恒容条件下,只发生反应I,测得平衡体系中
 的体积分数(
的体积分数( )与x[
)与x[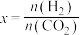 ,
,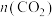 和
和 为初始的物质的量]的关系如图1所示。图中a、b、c、d四点
为初始的物质的量]的关系如图1所示。图中a、b、c、d四点 转化率最高的是
转化率最高的是
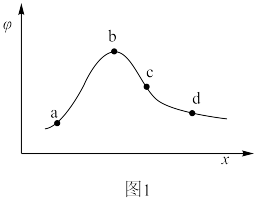
 的合金储存氢气的物质的量为
的合金储存氢气的物质的量为 )。
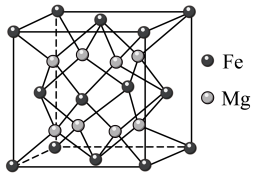
)。
您最近一年使用:0次
7 . 钌(Ru)是地球上丰度最小的元素,钌的产品广泛应用于电子、航空航天、化工等领域。从某种失效的钌催化剂(主要成分为Ru、ZnO、 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性:
(1)“煅烧”的目的是___________ 。
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为 的化学方程式为
的化学方程式为___________ 。
② 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是___________ 。
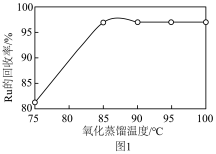
(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是___________ 。___________ 。
(5)钌多活性位点催化剂(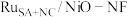 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。___________ 。
②催化剂的活性位点在催化过程中的主要作用是___________ 。
③分析图2-a推测 的“吸附解离”主要发生在
的“吸附解离”主要发生在___________ (填“钌原子”、“钌团簇”或“NiO”)位点上,若有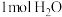 参与该过程,则变化的能量为
参与该过程,则变化的能量为___________ kJ(保留1位小数:已知: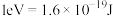 )。
)。
④分析图2-b并说明 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因___________ 。
 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: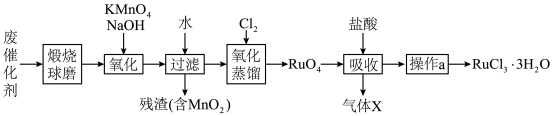
 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: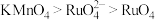
(1)“煅烧”的目的是
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为
 的化学方程式为
的化学方程式为②
 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是
(5)钌多活性位点催化剂(
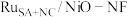 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
②催化剂的活性位点在催化过程中的主要作用是
③分析图2-a推测
 的“吸附解离”主要发生在
的“吸附解离”主要发生在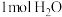 参与该过程,则变化的能量为
参与该过程,则变化的能量为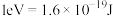 )。
)。④分析图2-b并说明
 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因
您最近一年使用:0次
解题方法
8 . 离子液体在液液萃取、电化学、有机合成等方面有广泛应用。一种离子液体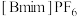 (相对分子质量284)的制备方法如下:
(相对分子质量284)的制备方法如下:
①在如图所示的三颈烧瓶中加入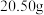 N-甲基咪唑,在
N-甲基咪唑,在 保护下缓慢滴加等物质的量的正溴丁烷,保持70℃回流30小时,得到液态
保护下缓慢滴加等物质的量的正溴丁烷,保持70℃回流30小时,得到液态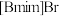 粗品。
粗品。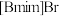 。
。
③将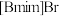 溶于水,加入烧瓶中,缓慢滴加含等物质的量
溶于水,加入烧瓶中,缓慢滴加含等物质的量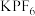 的溶液,室温下搅拌10小时,静置后分液。
的溶液,室温下搅拌10小时,静置后分液。
④所得产物减压蒸馏,用水洗涤,干燥,得到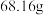 产品。
产品。
回答下列问题:
(1)仪器 的名称为
的名称为_____ 。
(2) -甲基咪唑与正溴丁烷或水混合均可得到澄清溶液,
-甲基咪唑与正溴丁烷或水混合均可得到澄清溶液, -甲基咪唑与水互溶的原因是
-甲基咪唑与水互溶的原因是_____ 。步骤①中观察到液体由澄清变浑浊再变澄清,变浑浊的原因是_____ 。
(3)步骤②减压蒸馏除去的物质主要为_____ 。
(4)步骤④检验产物已洗涤干净的方法是_____ 。
(5)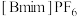 的产率为
的产率为_____ 。
(6)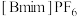 可代替
可代替 做萃取剂,其优点之一是比
做萃取剂,其优点之一是比 难挥发。
难挥发。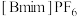 比
比 沸点高的原因是
沸点高的原因是_____ 。
(7)以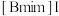 与
与 的混合液作为离子导体的一种染料(Dye)敏化太阳能电池,工作原理如图所示,光照射时发生电极反应:
的混合液作为离子导体的一种染料(Dye)敏化太阳能电池,工作原理如图所示,光照射时发生电极反应: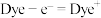 。已知
。已知 ,该太阳能电池中染料再生的离子方程式为
,该太阳能电池中染料再生的离子方程式为_____ 。
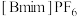 (相对分子质量284)的制备方法如下:
(相对分子质量284)的制备方法如下: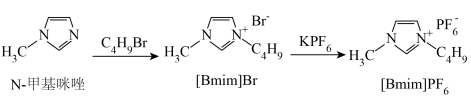
①在如图所示的三颈烧瓶中加入
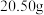 N-甲基咪唑,在
N-甲基咪唑,在 保护下缓慢滴加等物质的量的正溴丁烷,保持70℃回流30小时,得到液态
保护下缓慢滴加等物质的量的正溴丁烷,保持70℃回流30小时,得到液态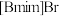 粗品。
粗品。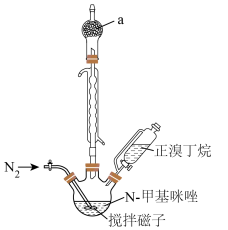
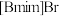 。
。③将
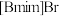 溶于水,加入烧瓶中,缓慢滴加含等物质的量
溶于水,加入烧瓶中,缓慢滴加含等物质的量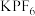 的溶液,室温下搅拌10小时,静置后分液。
的溶液,室温下搅拌10小时,静置后分液。④所得产物减压蒸馏,用水洗涤,干燥,得到
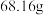 产品。
产品。回答下列问题:
(1)仪器
 的名称为
的名称为(2)
 -甲基咪唑与正溴丁烷或水混合均可得到澄清溶液,
-甲基咪唑与正溴丁烷或水混合均可得到澄清溶液, -甲基咪唑与水互溶的原因是
-甲基咪唑与水互溶的原因是(3)步骤②减压蒸馏除去的物质主要为
(4)步骤④检验产物已洗涤干净的方法是
(5)
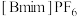 的产率为
的产率为(6)
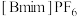 可代替
可代替 做萃取剂,其优点之一是比
做萃取剂,其优点之一是比 难挥发。
难挥发。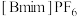 比
比 沸点高的原因是
沸点高的原因是(7)以
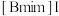 与
与 的混合液作为离子导体的一种染料(Dye)敏化太阳能电池,工作原理如图所示,光照射时发生电极反应:
的混合液作为离子导体的一种染料(Dye)敏化太阳能电池,工作原理如图所示,光照射时发生电极反应: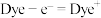 。已知
。已知 ,该太阳能电池中染料再生的离子方程式为
,该太阳能电池中染料再生的离子方程式为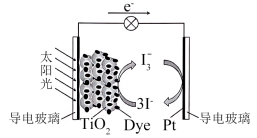
您最近一年使用:0次
名校
9 . 苯巴比妥是一种巴比妥类的镇静剂及安眠药,其合成路线如下所示(部分试剂和产物已略去):
(1)A B的反应试剂与条件为
B的反应试剂与条件为________ ,E含有的官能团名称为________ 。
(2)D的化学名称为________ 。
(3)F 苯巴比妥的化学方程式为
苯巴比妥的化学方程式为________ 。
(4)符合下列条件的苯巴比妥的同分异构体共有________ 种。
①分子中有2个苯环 ②既能与NaOH溶液反应也能与盐酸反应 ③核磁共振氢谱共5组峰
(5)苯巴比妥钠(结构为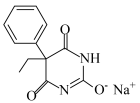 )是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:
)是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:
①苯巴比妥钠比苯巴比妥更适用于静脉注射:________
②苯巴比妥钠的水溶液易变质,需制成粉针剂(将药物与试剂混合后,经消毒干燥形成的粉状物品)保存:________ 。
(6)乙基巴比妥也是一种常用镇静剂,可用 和
和 等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整
等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整_______ 。

已知:ⅰ.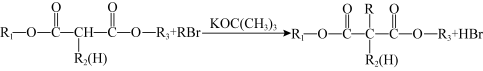
ⅱ.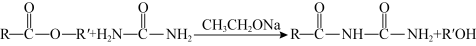
(1)A
 B的反应试剂与条件为
B的反应试剂与条件为(2)D的化学名称为
(3)F
 苯巴比妥的化学方程式为
苯巴比妥的化学方程式为(4)符合下列条件的苯巴比妥的同分异构体共有
①分子中有2个苯环 ②既能与NaOH溶液反应也能与盐酸反应 ③核磁共振氢谱共5组峰
(5)苯巴比妥钠(结构为
 )是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:
)是苯巴比妥的钠盐,两者均有镇静安眠的疗效。请从结构—性质—用途的角度分析以下原因:①苯巴比妥钠比苯巴比妥更适用于静脉注射:
②苯巴比妥钠的水溶液易变质,需制成粉针剂(将药物与试剂混合后,经消毒干燥形成的粉状物品)保存:
(6)乙基巴比妥也是一种常用镇静剂,可用
 和
和 等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整
等为原料合成,参照上述合成路线,在方框内写出相应的有机物,在箭头上下方写出适当的反应条件,将合成路线补充完整
您最近一年使用:0次
名校
10 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。
的制取、性质及其应用。按要求回答下列问题。
已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)
(无色)
【实验ⅰ】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 溶液(
溶液( )中通入
)中通入 一段时间,至C中溶液的pH为7时向其中滴加一定量
一段时间,至C中溶液的pH为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)盛装稀盐酸的仪器名称为________ ,试剂a为________ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是________ 。
(3)pH为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为________ 。
(4)同学甲在C中出现白色沉淀之后继续通 ,阐述你认为同学甲的操作合理与否及理由
,阐述你认为同学甲的操作合理与否及理由________ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质 ,请写出步骤②反应的离子方程式:
,请写出步骤②反应的离子方程式:_________ 。
(6)对比实验ⅱ和实验ⅲ,得出实验结论(填1点即可):_________ 。
【实验ⅳ】探究 的应用
的应用
(7)将 溶于乳酸
溶于乳酸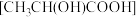 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是________ 。
 的制取、性质及其应用。按要求回答下列问题。
的制取、性质及其应用。按要求回答下列问题。已知:①
 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)
(无色)【实验ⅰ】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)实验i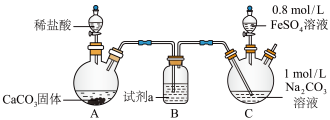
 溶液(
溶液( )中通入
)中通入 一段时间,至C中溶液的pH为7时向其中滴加一定量
一段时间,至C中溶液的pH为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)盛装稀盐酸的仪器名称为
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)pH为7时滴加一定量
 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在C中出现白色沉淀之后继续通
 ,阐述你认为同学甲的操作合理与否及理由
,阐述你认为同学甲的操作合理与否及理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质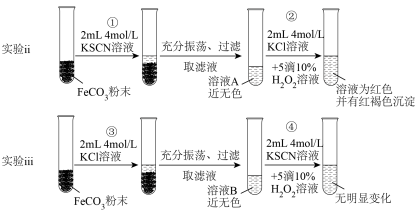
 ,请写出步骤②反应的离子方程式:
,请写出步骤②反应的离子方程式:(6)对比实验ⅱ和实验ⅲ,得出实验结论(填1点即可):
【实验ⅳ】探究
 的应用
的应用(7)将
 溶于乳酸
溶于乳酸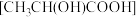 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
您最近一年使用:0次



