解题方法
1 . 将55g铁片放入硫酸铜溶液片刻,取出洗涤干燥后称重,质量为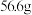 ,求参加反应的铁和生成的铜的质量
,求参加反应的铁和生成的铜的质量___________ 。
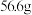 ,求参加反应的铁和生成的铜的质量
,求参加反应的铁和生成的铜的质量
您最近一年使用:0次
2 . 某铁的氧化物中含氧化亚铁14.37%,三氧化二铁47.91%及四氧化三铁; 37.72%。称取此混合物10.0 g,加入100.0 mLx mol·L-1HCl溶液,立即通入N2 ,溶解完成后,加入7.2493 g铁粉(假定铁粉与HCl不反应)。待溶液变澄清后,滴入5.00 mol·L-1NaOH溶液200.0 mL。此时恰好完全生成白色沉淀,试求x值。___________________________
您最近一年使用:0次
3 . 自然界存在的某天然碱(纯净物)的化学组成可表示为aNa2CO3、bNaHCO3、cH2O(a、b、c为正整数)。现称取不同质量的天然碱样品,溶于水后,分别逐滴加入相同浓度的盐酸溶液,30mL,产生CO2的体积(标准状况)如图所示。
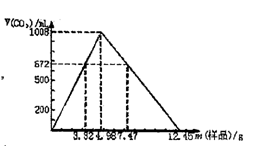
(1)若用2.49g样品进行同样的实验时,产生CO2的体积为_______ mL(标准状况)。
(2)另取3.32天然碱样品于200°C加热至完全分解(200°C时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,试通过计算确定该天然碱的化学式_______ 。
(3)实验中所用盐酸的物质的量浓度为_______ 。

(1)若用2.49g样品进行同样的实验时,产生CO2的体积为
(2)另取3.32天然碱样品于200°C加热至完全分解(200°C时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,试通过计算确定该天然碱的化学式
(3)实验中所用盐酸的物质的量浓度为
您最近一年使用:0次
解题方法
4 . 某多元化合物(含结晶水)是液流电池中解决阳极电解质和阴极电解质被污染的有用材料。该化合物中一些元素的质量百分数为:金属(M):21.67%,硫(S):13.64%,氧(O):61.26%。该化合物在水溶液中与氯化钡的盐酸溶液反应,产生白色沉淀。试推算出该化合物的化学式_______ 。
您最近一年使用:0次
解题方法
5 . 氮元素的单质及其化合物是化学研究的热点。回答下列问题:
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为_______ 。
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为_______ L(标准状况下)。
(2)一定温度时,在体积为2 L的恒容反应器中发生反应: ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
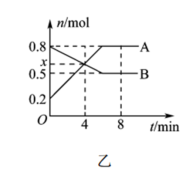
①A为_______ (填化学式)。
②4 min时,v正_______ (填“>”“<”或“=”) v逆。
③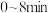 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)=_______ (保留两位有效数字) 。
。
④
_______ ,反应进行4 min时,N2的转化率为_______  。
。
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为
(2)一定温度时,在体积为2 L的恒容反应器中发生反应:
 ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
①A为
②4 min时,v正
③
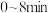 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)= 。
。④

 。
。
您最近一年使用:0次
2021-07-17更新
|
712次组卷
|
4卷引用:安徽省合肥市六校2020-2021学年高一下学期期末联考化学试题
解题方法
6 . 燃烧法是测定有机物分子式的一种重要方法。将0.1mol某烃在氧气中完全燃烧,得到二氧化碳在标准状况下体积为11.2L,生成水为10.8g,求:
(1)该烃的分子式___________ 。
(2)写出可能的结构简式___________ 。
(1)该烃的分子式
(2)写出可能的结构简式
您最近一年使用:0次
2021-07-09更新
|
410次组卷
|
2卷引用:安徽省蚌埠市2020-2021学年高一下学期期末考试化学试题
名校
7 . 一定温度下,在容积为VL的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
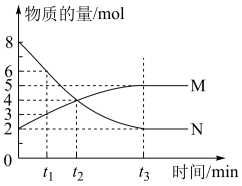
(1)该反应的化学反应方程式是___________ ;
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:___________ ;
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=___________ L;
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是___________ (填序号)
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
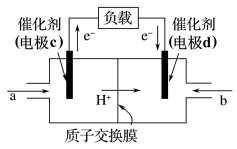
①则电极d是___________  填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为___________ ;
②若线路中转移2mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。

(1)该反应的化学反应方程式是
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
①则电极d是
 填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为②若线路中转移2mol电子,则该燃料电池理论上消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2021-07-09更新
|
840次组卷
|
4卷引用:安徽省安庆市2020-2021学年高一下学期期末考试化学试题
解题方法
8 . 在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如表(气体体积均为标准状况下测得):
(1)甲组实验中,盐酸_____ ;乙组实验中,盐酸_____ (填“过量“、“适量“或“不足“)。
(2)该盐酸的物质的量浓度_____ 。
(3)合金中Mg、Al的物质的量之比为____ 。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为 ,并使Mg2+刚好沉淀完全,则溶液中
,并使Mg2+刚好沉淀完全,则溶液中 的物质的量为
的物质的量为_____ mol;溶液中Na+的物质的量为______ mol。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 0.255 | 0.385 | 0.459 |
| 生成气体/ml | 280 | 336 | 336 |
(1)甲组实验中,盐酸
(2)该盐酸的物质的量浓度
(3)合金中Mg、Al的物质的量之比为
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为
 ,并使Mg2+刚好沉淀完全,则溶液中
,并使Mg2+刚好沉淀完全,则溶液中 的物质的量为
的物质的量为
您最近一年使用:0次
9 . 把一定质量的镁、铝混合物投入到1 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入1 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
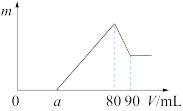
(1)加NaOH过程中有关反应的离子方程式为H++OH-=H2O、_______ 、_______ 、_______ 。
(2)金属铝的质量为_______ 。
(3)a的取值范围是_______ 。
(4)n(Mg)/n(Al)的最大值是_______ 。

(1)加NaOH过程中有关反应的离子方程式为H++OH-=H2O、
(2)金属铝的质量为
(3)a的取值范围是
(4)n(Mg)/n(Al)的最大值是
您最近一年使用:0次
2021-06-21更新
|
306次组卷
|
2卷引用:安徽省池州市第一中学2021-2022学年高一上学期12月月考化学试题
名校
解题方法
10 . (1)常温下,已知0.1mol·L-1一元酸HA溶液中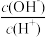 =1×108。
=1×108。
①常温下,0.1mol·L-1HA溶液的pH=___ ;写出该酸(HA)与NaOH溶液反应的离子方程式:___ 。
②0.2mol·L1HA溶液与0.1mol·L1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)-c(OH-)=___ mol·L1。(溶液体积变化忽略不计)
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___ 。
①该温度下(t℃),将100mL0.1mol·L1的稀H2SO4溶液与100mL0.4mol·L1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___ 。
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:___ 。
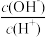 =1×108。
=1×108。①常温下,0.1mol·L-1HA溶液的pH=
②0.2mol·L1HA溶液与0.1mol·L1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)-c(OH-)=
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=
①该温度下(t℃),将100mL0.1mol·L1的稀H2SO4溶液与100mL0.4mol·L1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:
您最近一年使用:0次



