名校
解题方法
1 . 将64g铜与160mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)在标准状况下,NO的体积为___________ L,NO2的体积为___________ L。
(2)参加反应的HNO3的物质的量是___________ 。
(1)在标准状况下,NO的体积为
(2)参加反应的HNO3的物质的量是
您最近一年使用:0次
名校
解题方法
2 . (1)反应3A(g)+B(g)=2C(g)在三种不同的条件下进行反应,一段时间后,测得的反应速率用不同的物质表示为:①vA=1mol/(L·min);②vC=0.5mol/(L·min);③vB=0.5mol/(L·min),则在三种不同条件下该反应速率由大到小的关系是___ (请用序号表示)。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
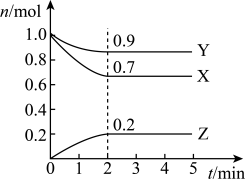
①该反应的化学方程式为___ 。
②反应开始至2min,以气体Z表示的平均反应速率为___ 。
③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量___ (填“增大”、“减小”或“不变”,下同),混合气体密度比起始时___ 。
④上述反应,在第2min时,X的转化率为___ 。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
②反应开始至2min,以气体Z表示的平均反应速率为
③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量
④上述反应,在第2min时,X的转化率为
您最近一年使用:0次
2021-06-02更新
|
384次组卷
|
6卷引用:安徽省池州市江南教育集团2021届高三上学期1月月考化学试题
3 . 工业上生产的纯碱常含有少量的NaCl。现将11.8g工业纯碱溶于水中得到100mL溶液,再加入足量稀盐酸,收集到2.24L(标准状况下测定)
(1)求原混合物溶液中Na2CO3的物质的量浓度;___________
(2)求混合物中Na2CO3的质量分数。___________
(1)求原混合物溶液中Na2CO3的物质的量浓度;
(2)求混合物中Na2CO3的质量分数。
您最近一年使用:0次
解题方法
4 . (1)25 ℃时,0.05mol·L-1H2SO4溶液的pH=_______ ,0.01 mol·L-1NaOH溶液的pH=_______ 。
(2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=_______ ;若温度不变,滴入稀盐酸,使c(H+)=5×10-4 mol·L-1,则此时溶液中由水电离产生的c(H+)=_______ 。
(2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=
您最近一年使用:0次
解题方法
5 . 含钠化合物与含硫化合物可发生多种反应,请回答下列问题:
(1)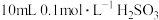 溶液与6.9gNa反应,生成的H2在标准状况下的体积为
溶液与6.9gNa反应,生成的H2在标准状况下的体积为___ L。
(2)SO2与少量NaOH溶液反应的离子方程式为___ 。
(3)查阅资料知Na2O2具有强氧化性,Na2O2与SO2反应的化学方程式为____ 。
(4)用热的NaOH溶液与硫粉反应中,氧化剂与还原剂的质量之比为___ ,当转移0.4mol电子时,生成Na2S的质量为___ g。
(1)
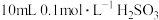 溶液与6.9gNa反应,生成的H2在标准状况下的体积为
溶液与6.9gNa反应,生成的H2在标准状况下的体积为(2)SO2与少量NaOH溶液反应的离子方程式为
(3)查阅资料知Na2O2具有强氧化性,Na2O2与SO2反应的化学方程式为
(4)用热的NaOH溶液与硫粉反应中,氧化剂与还原剂的质量之比为
您最近一年使用:0次
名校
6 . 在10L容器中,加入4mol的SO2(g)和4mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。5分钟时达到平衡状态,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。5分钟时达到平衡状态,测得容器中SO2(g)的转化率为50%。
(1)化学平衡时化学平衡常数___________ ,5分钟内NO2的反应速率为___________ ;
(2)当达到的平衡状态时,继续向容器中充入2mol的SO2(g)、1mol的NO2(g)、2molSO3(g)和2molNO(g),则v正___________ v逆(填“>”“<”或“=”)
(3)该温度下、该容器中,再继续加入2mol的SO2(g),则整个过程中,SO2的转化率由50%变为___________ %,NO2的转化率为___________ %
 SO3(g)+NO(g)。5分钟时达到平衡状态,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。5分钟时达到平衡状态,测得容器中SO2(g)的转化率为50%。(1)化学平衡时化学平衡常数
(2)当达到的平衡状态时,继续向容器中充入2mol的SO2(g)、1mol的NO2(g)、2molSO3(g)和2molNO(g),则v正
(3)该温度下、该容器中,再继续加入2mol的SO2(g),则整个过程中,SO2的转化率由50%变为
您最近一年使用:0次
解题方法
7 . 一定量的 固体与
固体与 盐酸恰好完全反应,生成标准状况下
盐酸恰好完全反应,生成标准状况下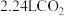 ,试计算:
,试计算:
(1) 的质量
的质量______ ;
(2)盐酸的物质的量浓度______ 。
 固体与
固体与 盐酸恰好完全反应,生成标准状况下
盐酸恰好完全反应,生成标准状况下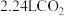 ,试计算:
,试计算:(1)
 的质量
的质量(2)盐酸的物质的量浓度
您最近一年使用:0次
2021-03-23更新
|
1064次组卷
|
3卷引用:安徽省芜湖市2020-2021学年高二下学期期中联考化学(文)试题
名校
8 . 五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)⇌PCl5(g)ΔH =-93.0kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0mol PCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:
(1)0~150 s内的平均反应速率υ(PCl3)=_______ mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为(可用分数表示)_______ 。
(3)反应至250 s时,该反应放出的热量为_______ kJ。
(4)下列关于上述反应的说法中,正确的是(填字母序号)_______ 。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
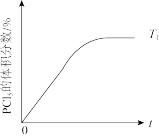
(5)温度为T1时,混合气体中PCl5的体积分数随时间t变化的示意图如图。其他条件相同,请在图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线_______ 。
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率υ(PCl3)=
(2)该温度下,此反应的化学平衡常数的数值为(可用分数表示)
(3)反应至250 s时,该反应放出的热量为
(4)下列关于上述反应的说法中,正确的是(填字母序号)
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
(5)温度为T1时,混合气体中PCl5的体积分数随时间t变化的示意图如图。其他条件相同,请在图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线

您最近一年使用:0次
2021-03-23更新
|
194次组卷
|
2卷引用:安徽省六安市新安中学2020-2021学年高二下学期入学考试(普通班)化学试题
名校
9 . 化学科学家采用丙烯歧化法制取乙烯和丁烯的反应原理为2C3H6(g) C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:
(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
①a=_______ ,p初始:p5min=_______ 。
②其他条件不变,若缩小反应器的体积,则C3H6转化率_______ (填“增大”“减小”或“不变”)。
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:
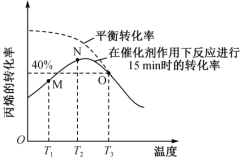
①N点_______ (填“有”或“没有”)达到平衡状态,原因是_______ 。
②M→N过程中C3H6转化率升高的原因是_______ 。
③T3时Kc=_______ ,若其他条件不变,往反应器中再加入2 mol C3H6,反应重新达到平衡时混合体系中乙烯的体积分数为_______ 。
 C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| C2H4的物质的量/mol | 0 | 0.8 | 1.2 | 1.5 | a | 1.5 |
①a=
②其他条件不变,若缩小反应器的体积,则C3H6转化率
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:

①N点
②M→N过程中C3H6转化率升高的原因是
③T3时Kc=
您最近一年使用:0次
2021-03-21更新
|
213次组卷
|
3卷引用:安徽省江淮名校2020-2021学年高二下学期开学联考化学试题
解题方法
10 . (1)0.3molNH3分子中所含原子数与__ 个H2O分子中所含原子数相等。
(2)含有0.4molAl3+的Al2(SO4)3溶液中所含SO 的物质的量是
的物质的量是__ 。
(3)计算4.9gH2SO4中含有的氧原子数___ 。
(4)1.204×1023个二氧化碳分子的质量是多少___ 。
(2)含有0.4molAl3+的Al2(SO4)3溶液中所含SO
 的物质的量是
的物质的量是(3)计算4.9gH2SO4中含有的氧原子数
(4)1.204×1023个二氧化碳分子的质量是多少
您最近一年使用:0次



