21-22高一下·上海浦东新·期中
名校
解题方法
1 . 铁元素在化合物中有多种化合价,常见的有+2,+3价。
Ⅰ.某溶液中有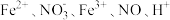 和
和 六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
(1)请写出该反应的离子方程式___________ 。
(2)该反应中氧化剂与还原剂的物质的量之比为___________ ;产生2mol还原产物时转移电子的总数为___________ 。
Ⅱ.磁铁矿的主要成分是 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
①取少量磁铁矿石样品,加入过量的试剂A溶解。
②验证:
取溶解后的液体少许,加入少量试剂B,观察现象。
③验证:
取溶解后的液体少许,加入少量试剂C,观察现象。
(3)试剂A为___________ ,发生反应的离子方程式为___________ 。
(4)试剂B为___________ ,观察到___________ ,则证明有 。
。
(5)试剂C为___________ ,观察到___________ ,则证明有 。
。
Ⅰ.某溶液中有
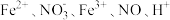 和
和 六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
六种粒子,分别属于同一氧化还原反应中的反应物和生成物。(1)请写出该反应的离子方程式
(2)该反应中氧化剂与还原剂的物质的量之比为
Ⅱ.磁铁矿的主要成分是
 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:①取少量磁铁矿石样品,加入过量的试剂A溶解。
②验证:

取溶解后的液体少许,加入少量试剂B,观察现象。
③验证:

取溶解后的液体少许,加入少量试剂C,观察现象。
(3)试剂A为
(4)试剂B为
 。
。(5)试剂C为
 。
。
您最近一年使用:0次
解题方法
2 . 化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置(要求:A管和B管测量燃烧产物)。

回答下列问题:
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是_____ 。
(2)C装置中浓硫酸的作用是_____ 。
(3)D装置中MnO2的作用是_____ 。
(4)若准确称取9.0g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加13.2g,B管质量增加5.4g,则该有机物的最简式为_____ 。
(5)若使9.0gA汽化,测得其密度是相同条件下H2的45倍,则A的相对分子质量为_____ 。

回答下列问题:
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是
(2)C装置中浓硫酸的作用是
(3)D装置中MnO2的作用是
(4)若准确称取9.0g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加13.2g,B管质量增加5.4g,则该有机物的最简式为
(5)若使9.0gA汽化,测得其密度是相同条件下H2的45倍,则A的相对分子质量为
您最近一年使用:0次
解题方法
3 . 某煤化工厂废水含有大量有机物、氨氮、氰化物、悬浮颗粒等有害物质,处理流程如图所示。
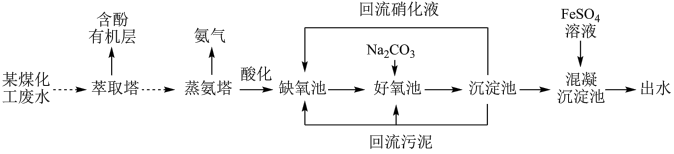
(1)萃取塔中经过______ (填写操作名称)可将含酚有机层分离出来。
(2)蒸氨塔中需要连续加入碱液并保持较高温度。请从化学平衡角度解释回答下列问题。
①写出蒸氨塔中主要的化学平衡的离子方程式:______ 。
②加入碱液以及保持较高温度的原因:______ 。
(3)缺氧池中含有NH 及CN-,其中CN-(C为+2价)可被回流硝化液中的NO
及CN-,其中CN-(C为+2价)可被回流硝化液中的NO 氧化为无毒气体。请预测CN-反应后的产物为
氧化为无毒气体。请预测CN-反应后的产物为______ 和______ 。请分析由蒸氨塔到缺氧池工序酸化的目的:______ 。
(4)好氧池中富含O2与NH 反应后的产物为NO
反应后的产物为NO ,写出该反应的离子方程式:
,写出该反应的离子方程式:______ 。
(5)出水检测
甲醛法可以测定水样中NH 的含量,其反应原理为:4NH
的含量,其反应原理为:4NH +6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。
+6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。
实验步骤:
i.移取VmL出水样品,以酚酞为指示剂,用cmol/LNaOH标准液滴定至终点,中和样品中的酸。消耗NaOH溶液的体积为V1mL;
ii.另取同样体积的样品,加入足量的中性甲醛溶液,摇匀,静置5min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V2mL。
①步骤ii中滴定至终点的现象为______ 。
②该水样中残留NH 浓度为
浓度为______ mol/L。

(1)萃取塔中经过
(2)蒸氨塔中需要连续加入碱液并保持较高温度。请从化学平衡角度解释回答下列问题。
①写出蒸氨塔中主要的化学平衡的离子方程式:
②加入碱液以及保持较高温度的原因:
(3)缺氧池中含有NH
 及CN-,其中CN-(C为+2价)可被回流硝化液中的NO
及CN-,其中CN-(C为+2价)可被回流硝化液中的NO 氧化为无毒气体。请预测CN-反应后的产物为
氧化为无毒气体。请预测CN-反应后的产物为(4)好氧池中富含O2与NH
 反应后的产物为NO
反应后的产物为NO ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)出水检测
甲醛法可以测定水样中NH
 的含量,其反应原理为:4NH
的含量,其反应原理为:4NH +6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。
+6HCHO=3H++6H2O+(CH2)6N4H+,后用NaOH标准溶液滴定反应生成的酸(滴定时,1mol(CH2)6N4H+与1molH+相当)。实验步骤:
i.移取VmL出水样品,以酚酞为指示剂,用cmol/LNaOH标准液滴定至终点,中和样品中的酸。消耗NaOH溶液的体积为V1mL;
ii.另取同样体积的样品,加入足量的中性甲醛溶液,摇匀,静置5min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V2mL。
①步骤ii中滴定至终点的现象为
②该水样中残留NH
 浓度为
浓度为
您最近一年使用:0次
4 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 验证CH2=CHCHO 分子中的碳碳双键 | 取样品与过量溴水混合, 充分反应观察现象 | 溴水褪色,说明样品分子中含有碳碳双键 |
| B | 检验CO还原Fe2O3的生成物中是否含有Fe3O4 | 将适量反应后的固体溶于稀盐酸中,取少量溶解液于试管中,滴加KSCN溶液 | 溶液变血红色,则证明还原产物中含有Fe3O4 |
| C | 比较HClO与CH3COOH酸性强弱 | 将pH相同的NaClO溶液和CH3COONa溶液稀释相同倍数 | pH (NaClO)>pH(CH3COONa),说明HClO酸性弱于CH3COOH |
| D | 鉴定某涂改液中是否存在含氯化合物 | 取涂改液与KOH溶液混合加热充分反应,取上层清液,硝酸酸化,加入硝酸银溶液,观察现象 | 出现白色沉淀,说明涂改液中存在含氯化合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
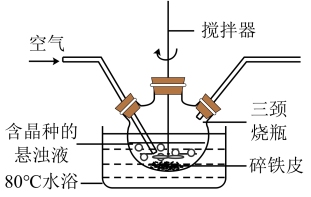
5 . 铁黄( )是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入
)是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入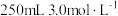 硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在
硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在 水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在 的实验方法为
的实验方法为_________ 。
(2)结合反应原理解释加入过量碎铁皮的作用是_________ 。
(3)测定样品中铁黄的质量分数。
①配制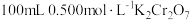 标准溶液。实验过程可描述为
标准溶液。实验过程可描述为_________ ,继续加入蒸馏水至离刻度线 处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品 置于
置于 锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的
锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的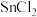 溶液(将
溶液(将 还原为
还原为 )充分反应,再除去过量的
)充分反应,再除去过量的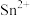 。用上述配制的
。用上述配制的 标准溶液滴定至终点(
标准溶液滴定至终点( ),消耗
),消耗 溶液
溶液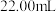 。计算该样品中铁黄的质量分数
。计算该样品中铁黄的质量分数_________ (写出计算过程)。
(4)铁和氨在 时可发生置换反应,一种产物的晶胞结构如图所示。
时可发生置换反应,一种产物的晶胞结构如图所示。
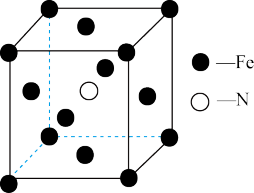
①该产物的化学式为_________ 。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________ 。
 )是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入
)是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入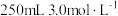 硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在
硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在 水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在
 的实验方法为
的实验方法为(2)结合反应原理解释加入过量碎铁皮的作用是
(3)测定样品中铁黄的质量分数。
①配制
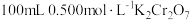 标准溶液。实验过程可描述为
标准溶液。实验过程可描述为 处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。②称取铁黄样品
 置于
置于 锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的
锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的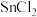 溶液(将
溶液(将 还原为
还原为 )充分反应,再除去过量的
)充分反应,再除去过量的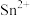 。用上述配制的
。用上述配制的 标准溶液滴定至终点(
标准溶液滴定至终点( ),消耗
),消耗 溶液
溶液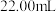 。计算该样品中铁黄的质量分数
。计算该样品中铁黄的质量分数(4)铁和氨在
 时可发生置换反应,一种产物的晶胞结构如图所示。
时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来
您最近一年使用:0次
2022-11-12更新
|
471次组卷
|
2卷引用:江苏省盐城市2023届高三上学期期中考试化学试题
名校
解题方法
6 . 重铬酸铵[(NH4)2Cr2O7]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7]的装置如图所示(夹持装置略)。回答下列问题:
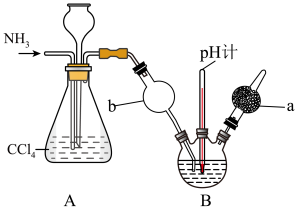
已知: (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。
(1)仪器a的名称是_______ ,A装置的作用为_______ 。
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是_______ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为_______ 。
②用_______ (填“酸式”或“碱式”)滴定管量取25.00mL样品溶液于250mL锥形瓶中。
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为_______ %。
⑤若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”、“偏小”或“不变”)。

已知:
 (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。(1)仪器a的名称是
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为
②用
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为
⑤若滴定终点时仰视读数,则测定的质量分数将
您最近一年使用:0次
7 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
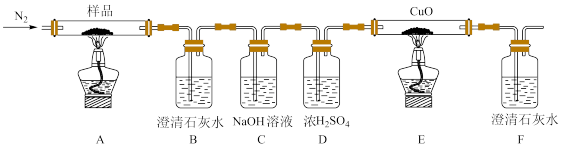
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:
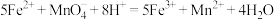
①配制溶液:实验中配制 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加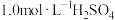 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ取20.00mL配制好的溶液于锥形瓶中,滴加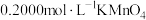 ,溶液至恰好完全反应。该操作的目的是
,溶液至恰好完全反应。该操作的目的是_______ 。
③步骤Ⅱ向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用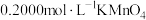 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。该晶体样品中铁的质量分数为
溶液20.00mL。该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

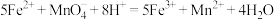
①配制溶液:实验中配制
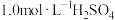 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
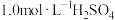 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ取20.00mL配制好的溶液于锥形瓶中,滴加
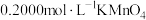 ,溶液至恰好完全反应。该操作的目的是
,溶液至恰好完全反应。该操作的目的是③步骤Ⅱ向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用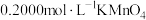 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。该晶体样品中铁的质量分数为
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 无水FeCl3是芳香烃取代反应常用的催化剂,它具有易水解、易升华的性质。某同学用5.60g干燥铁粉制得13.00g无水FeCl3样品,实验装置如图所示。下列说法正确的是
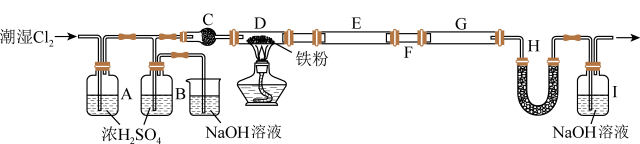

| A.该实验中FeCl3的产率为60% |
| B.装置C、H中的药品可以都为P2O5 |
| C.装置B用于干燥氯气,装置E和G用于收集产物 |
| D.可用K4[Fe(CN)6]溶液检验FeCl3产品中是否存在FeCl2 |
您最近一年使用:0次
2023-04-04更新
|
1836次组卷
|
10卷引用:湖北省圆创2023届高三3月联合测评化学试题
湖北省圆创2023届高三3月联合测评化学试题湖北省武汉市圆创联考2023届高三3月质检化学试题(已下线)化学-2023年高考押题预测卷03(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)(已下线)题型35 微型成套装置实验流程(已下线)T13-化学实验基础湖北省名校联盟2023届高三3月联合测评化学试题(已下线)选择题11-15四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题甘肃省天水市第一中学 第三中学联考2023-2024学年高三上学期第三次月考 化学试题(已下线)热点19 化学微型实验
9 . 亚氯酸钠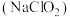 常用于纺织、造纸业漂白,也用于食品消毒、水处理等。
常用于纺织、造纸业漂白,也用于食品消毒、水处理等。
已知:①亚氯酸钠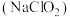 受热易分解;
受热易分解;
②纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。
I:制取 晶体
晶体
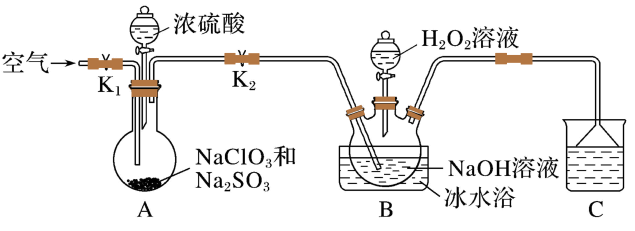
(1)实验过程中需要持续通入空气,目的是_______ 。
(2)装置A中产生 的化学方程式为
的化学方程式为_______ 。
(3)装置B中还原剂和氧化剂的物质的量之比为_______ ,还原产物为_______ ;反应结束后,为从溶液中得到 固体,采取减压蒸发而不用常压蒸发,原因是
固体,采取减压蒸发而不用常压蒸发,原因是_______ 。
(4)装置C的作用是_______ 。
II:测定亚氯酸钠的含量
实验步骤:①准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用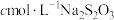 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液体积的平均值为V mL。(已知:
标准溶液体积的平均值为V mL。(已知: 、
、 )
)
(5)达到滴定终点时的现象为_______ 。
(6)该样品中 的质量分数为
的质量分数为_______ %(用含m、c、V的代数式表示)。在滴定操作正确的情况下,此实验测得结果偏高,可能原因为_______ (用离子方程式表示)。
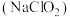 常用于纺织、造纸业漂白,也用于食品消毒、水处理等。
常用于纺织、造纸业漂白,也用于食品消毒、水处理等。已知:①亚氯酸钠
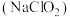 受热易分解;
受热易分解;②纯
 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。I:制取
 晶体
晶体
(1)实验过程中需要持续通入空气,目的是
(2)装置A中产生
 的化学方程式为
的化学方程式为(3)装置B中还原剂和氧化剂的物质的量之比为
 固体,采取减压蒸发而不用常压蒸发,原因是
固体,采取减压蒸发而不用常压蒸发,原因是(4)装置C的作用是
II:测定亚氯酸钠的含量
实验步骤:①准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用
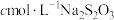 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液体积的平均值为V mL。(已知:
标准溶液体积的平均值为V mL。(已知: 、
、 )
)(5)达到滴定终点时的现象为
(6)该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
10 . 亚氯酸钠( )常用于纺织、造低业漂白,也用于食品消毒、水处理等。
)常用于纺织、造低业漂白,也用于食品消毒、水处理等。
【资科1】①亚氯酸钠( )受热易分解;②纯
)受热易分解;②纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下;③
易分解爆炸,一般用稀有气体或空气稀释到10%以下;③ 有强烈刺激性气味,易溶于水,不与水反应。
有强烈刺激性气味,易溶于水,不与水反应。
【实验一】制取 晶体
晶体
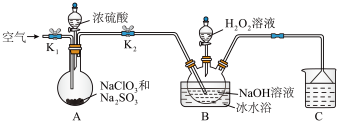
(1)实验过程中需要持续通入空气,目的是_______ 。
(2)装置C中漏斗的作用是_______ 。
(3)装置A的反应中还原剂和氧化剂的物质的量之比为_______ ,还原产物为_______ (填化学式)。
(4)写出装置B中反应的化学方程式并用单线桥法表示电子转移的方向和数目:_______ ;反应结束后,为从溶液中得到 固体,采取减压蒸发而不用常压蒸发,原因是
固体,采取减压蒸发而不用常压蒸发,原因是_______ 。
【实验二】测定亚氯酸钠的含量
【资料2】 ;
;
实验步骤:①准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成200 mL待测溶液。②移取50.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用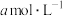
 标准溶液滴定至终点,重复2次,测得消耗标准溶液体积的平均值为V mL。
标准溶液滴定至终点,重复2次,测得消耗标准溶液体积的平均值为V mL。
(5)达到滴定终点时的现象为_______ 。
(6)该样品中 的质量分数为
的质量分数为_______ %(用含m、a、V的代数式表示)。
 )常用于纺织、造低业漂白,也用于食品消毒、水处理等。
)常用于纺织、造低业漂白,也用于食品消毒、水处理等。【资科1】①亚氯酸钠(
 )受热易分解;②纯
)受热易分解;②纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下;③
易分解爆炸,一般用稀有气体或空气稀释到10%以下;③ 有强烈刺激性气味,易溶于水,不与水反应。
有强烈刺激性气味,易溶于水,不与水反应。【实验一】制取
 晶体
晶体
(1)实验过程中需要持续通入空气,目的是
(2)装置C中漏斗的作用是
(3)装置A的反应中还原剂和氧化剂的物质的量之比为
(4)写出装置B中反应的化学方程式并用单线桥法表示电子转移的方向和数目:
 固体,采取减压蒸发而不用常压蒸发,原因是
固体,采取减压蒸发而不用常压蒸发,原因是【实验二】测定亚氯酸钠的含量
【资料2】
 ;
;
实验步骤:①准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成200 mL待测溶液。②移取50.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用
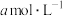
 标准溶液滴定至终点,重复2次,测得消耗标准溶液体积的平均值为V mL。
标准溶液滴定至终点,重复2次,测得消耗标准溶液体积的平均值为V mL。(5)达到滴定终点时的现象为
(6)该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次



