名校
解题方法
1 . 水合肼( )及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是
)及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是
 )及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是
)及其衍生物产品在许多工业中得到广泛的使用,可用作还原剂、抗氧剂、发泡剂等。一种利用NaClO溶液与氨气反应制备水合肼的装置如图所示。下列说法不正确的是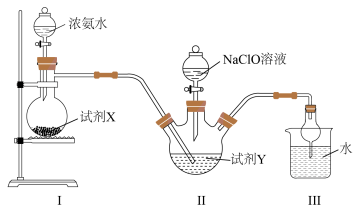
| A.Ⅰ中盛放浓氨水的仪器为分液漏斗 |
| B.试剂X可选择CaO固体 |
| C.为防倒吸,试剂Y可选择苯 |
D.Ⅱ中发生反应的化学方程式为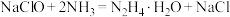 |
您最近一年使用:0次
2024-05-12更新
|
567次组卷
|
5卷引用:河南省周口市太康县第一高级中学2024-2025学年上学期第一次测试化学试题
河南省周口市太康县第一高级中学2024-2025学年上学期第一次测试化学试题广东省茂名市高州市2024届高三下学期高考适应性考试(三模)化学试题河北省衡水市部分示范性高中2024届高三下学期三模化学试题(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)暑假作业04 突破氧化还原反应及陌生方程式书写综合应用-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)
2 . 锂和铍是重要的稀有金属,被国内外视为战略性资源。一种从尾矿(主要含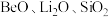 及
及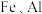 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图:
(1)“浸渣”中主要成分的晶体类型为_____ 。
(2)“沉铁”中生成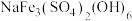 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为_____ ,该反应的离子方程式为_____ 。
(3)“萃取”时,以 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成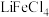 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生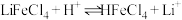 。
。
①“萃取”时还需要加入 ,其作用是
,其作用是_____ 。
②取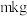 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为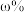 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为_____ (用含相关物理量字母的代数式表示)。
(4)实验室提纯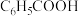 的方法是
的方法是_____ 。
(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表:
表中离子半径比的临界值是由“堆积—填隙模型”中阴阳离子的几何关系确定的,例如配位数为8时,阳离子进入阴离子形成的正方体空隙,正方体8个顶点处的阴离子相切,空隙处(正方体体心)的阳离子与8个阴离子也相切,此时可由相关几何关系求得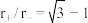 。
。
①
_____ 。
② 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:_____ 。
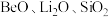 及
及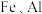 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图: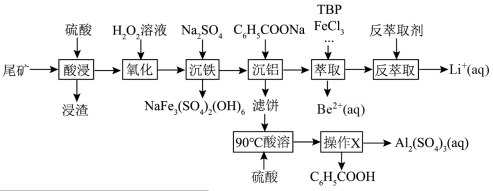
(1)“浸渣”中主要成分的晶体类型为
(2)“沉铁”中生成
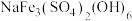 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为(3)“萃取”时,以
 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成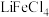 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生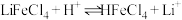 。
。①“萃取”时还需要加入
 ,其作用是
,其作用是②取
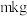 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为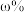 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为(4)实验室提纯
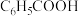 的方法是
的方法是(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的
 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表: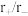 | 配位数 | 晶胞类型 |
 | 4 | 立方 |
 | 6 |  |
 | 8 |  |
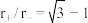 。
。①

②
 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:
您最近一年使用:0次
2024-05-12更新
|
183次组卷
|
2卷引用:2024届河南省信阳高级中学高三下学期考前最后一卷理科综合试题-高中化学
解题方法
3 .  还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。
 还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。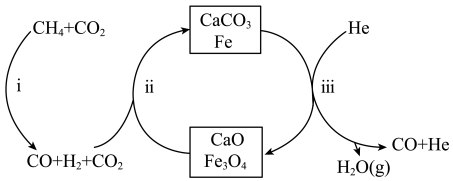
A.该反应的催化剂为 和 和 |
| B.过程iii在恒压条件下通入He,有利于增加CO的产量 |
| C.过程i、ii、iii均涉及置换反应 |
D.每生成4mol的CO,转移的电子数约为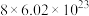 |
您最近一年使用:0次
2024-05-12更新
|
435次组卷
|
5卷引用:专题1 物质及其变化-氧化还原反应方程式的配平与计算
(已下线)专题1 物质及其变化-氧化还原反应方程式的配平与计算专题7 化学反应速率与化学平衡-化学平衡状态及平衡移动2024届山西省晋中市高三下学期5月高考适应训练考试理科综合试卷-高中化学(已下线)第01讲 物质的分类及转化(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题突破卷01 化学物质及其变化-2025年高考化学一轮复习考点通关卷(新高考通用)
名校
解题方法
4 . 某兴趣小组以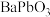 、
、 为原料进行了如下探究过程:
为原料进行了如下探究过程: 、
、 、
、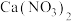 。请回答:
。请回答:
(1)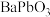 中铅元素的化合价为
中铅元素的化合价为___________ ,气体A的成分为___________ 。
(2)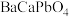 写成氧化物的形式
写成氧化物的形式___________ 。
(3)“富氧焙烧”过程发生反应的化学方程式为___________ 。
(4)下列说法正确的是___________。
(5)设计合理方案,定性检验D中的化学组成___________ 。
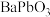 、
、 为原料进行了如下探究过程:
为原料进行了如下探究过程: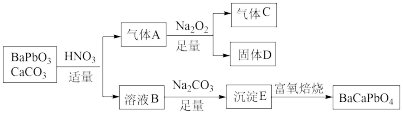
 、
、 、
、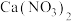 。请回答:
。请回答:(1)
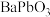 中铅元素的化合价为
中铅元素的化合价为(2)
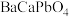 写成氧化物的形式
写成氧化物的形式(3)“富氧焙烧”过程发生反应的化学方程式为
(4)下列说法正确的是___________。
| A.硝酸在上述反应中体现出酸性和氧化性 | B. 可在潜水艇中作为氧气来源 可在潜水艇中作为氧气来源 |
C.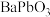 与 与 物质的量之比为 物质的量之比为 | D.可以用石英坩埚焙烧沉淀E |
(5)设计合理方案,定性检验D中的化学组成
您最近一年使用:0次
2024-05-10更新
|
48次组卷
|
3卷引用:河南省安阳市林州市林州市第一中学2023-2024学年高一下学期6月月考化学试题
解题方法
5 . 下列反应不符合哲学中“量变引起质变”观点的是
| A.锌与硫酸 | B.FeBr2溶液和氯水 |
| C.铜和硝酸 | D.氨气和氯化氢 |
您最近一年使用:0次
解题方法
6 . 澳大利亚昆士兰大学的王连洲教授团队设计了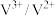 离子对作为氧化还原电子对提升
离子对作为氧化还原电子对提升 和
和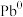 之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
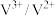 离子对作为氧化还原电子对提升
离子对作为氧化还原电子对提升 和
和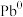 之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是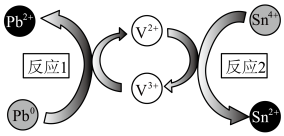
A.总反应为 | B.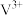 为中间产物, 为中间产物, 为催化剂 为催化剂 |
C.氧化性: | D.反应2中负极反应: |
您最近一年使用:0次
7 . 亚硝酸钠 是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
 是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是A.滴定前滴定管尖嘴处有气泡,滴定后无气泡会使测得的 含量偏高 含量偏高 |
B.亚硝酸根( )空间结构为V形 )空间结构为V形 |
| C.酸性高锰酸钾溶液可以鉴别食盐和亚硝酸钠 |
D.滴定过程离子反应为: |
您最近一年使用:0次
名校
解题方法
8 . 镍的氧化物M是蓄电池材料。某小组用含镍废料(成分为NiO、Ni2O3、FeO、MgO和SiO2等)制备M的工艺流程如图所示。
(1)固体2的主要成分是_______ (填化学式)。提高“酸浸”速率宜采用的措施有_______ (答两条)。
(2)“酸浸”中有无色无味且有助燃性的气体产生,该过程中发生反应的离子方程式为_______ 。
(3)已知: ,
, 。若浸出液中
。若浸出液中 ,当离子浓度
,当离子浓度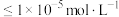 时认为已完全沉淀。用Na2CO3调节pH范围为
时认为已完全沉淀。用Na2CO3调节pH范围为_______ 。
(4)“系列操作”包括蒸发浓缩、_______ 、过滤、乙醇洗涤、干燥。用乙醇洗涤的目的是_______ 。
(5)灼烧NiSO4•7H2O时,剩余固体的质量与温度的变化关系如图1所示。_______ 。
(6)Nb和Ni组成合金,晶胞如图2所示。设 为阿伏加德罗常数的值。该晶胞密度为
为阿伏加德罗常数的值。该晶胞密度为_______  (只列计算式)。
(只列计算式)。

(1)固体2的主要成分是
(2)“酸浸”中有无色无味且有助燃性的气体产生,该过程中发生反应的离子方程式为
(3)已知:
 ,
, 。若浸出液中
。若浸出液中 ,当离子浓度
,当离子浓度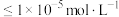 时认为已完全沉淀。用Na2CO3调节pH范围为
时认为已完全沉淀。用Na2CO3调节pH范围为(4)“系列操作”包括蒸发浓缩、
(5)灼烧NiSO4•7H2O时,剩余固体的质量与温度的变化关系如图1所示。

(6)Nb和Ni组成合金,晶胞如图2所示。设
 为阿伏加德罗常数的值。该晶胞密度为
为阿伏加德罗常数的值。该晶胞密度为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
2024-05-06更新
|
135次组卷
|
3卷引用:2024届河南省名校高三下学期压轴卷(1)理综试卷-高中化学
解题方法
9 . 元素周期表可以用于探寻各种元素间的内在联系。
(1)下列关于元素周期表的说法错误的是______ 。
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是______ 。
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式_______ 。
②写出Si在元素周期表中的位置_______ 。由碳族元素结构特点,可推测Pb3O4中Pb的化合价为_____ 。
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为______ 。
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=____ 。向其中通入一定量的氯气发生反应,当c(Fe2+):c(Cl﹣)=1:4时,离子方程式为_____ 。
(1)下列关于元素周期表的说法错误的是
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式
②写出Si在元素周期表中的位置
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=
您最近一年使用:0次
2024-05-05更新
|
95次组卷
|
2卷引用:河南省荥阳市京城高中2023-2024学年高一下学期3月月考化学试题
解题方法
10 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取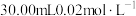 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: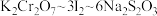 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: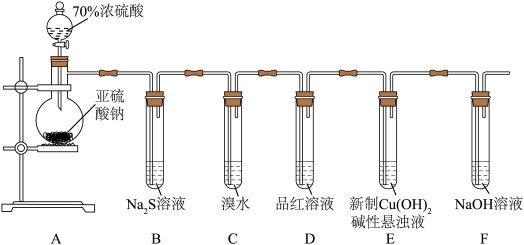
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取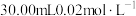 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
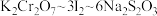 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
2024-05-05更新
|
247次组卷
|
2卷引用:河南省濮阳市名校2023-2024学年下学期高一联考化学试题



