1 . 碘微溶于水,若水中含I﹣,碘溶解度增大,因为存在平衡: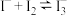 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:
(1)反应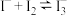 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:
I.将一定质量的单质Ⅰ2完全溶于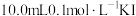 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
Ⅱ.实验测得上层溶液中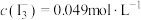 ;
;
Ⅲ.滴定下层溶液至终点时,消耗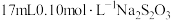 溶液
溶液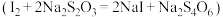 。
。
已知: 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即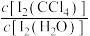 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
①分液时,使用的玻璃仪器有___________ 。
②该条件下反应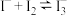 的平衡常数K=
的平衡常数K=___________ (保留三位有效数字)。
(2)某废碘液(含有Ⅰ2、 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:
i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为 ;
;
ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、 全部还原为
全部还原为 的实验现象是
的实验现象是___________ 。
②还原和浓缩的顺序不能交换,可能原因是___________ 。
③氧化时发生反应的离子方程式为___________ 。
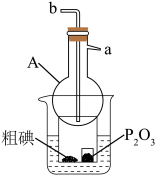
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是___________ ,进水口为___________ (填“a”或“b”),小烧杯中放置P2O5的作用是___________ 。
⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
由此得出的结论是___________ 。
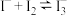 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:(1)反应
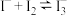 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:I.将一定质量的单质Ⅰ2完全溶于
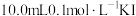 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;Ⅱ.实验测得上层溶液中
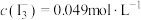 ;
;Ⅲ.滴定下层溶液至终点时,消耗
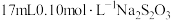 溶液
溶液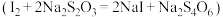 。
。已知:
 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即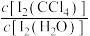 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。①分液时,使用的玻璃仪器有
②该条件下反应
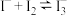 的平衡常数K=
的平衡常数K=(2)某废碘液(含有Ⅰ2、
 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为
 ;
;ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、
 全部还原为
全部还原为 的实验现象是
的实验现象是②还原和浓缩的顺序不能交换,可能原因是
③氧化时发生反应的离子方程式为
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是

⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
| 比例 | 1:0 | 1:1 | 1:2 | 1:3 | 1:4 | 1:5 |
| 萃取后碘水 | 红 | 浅黄红 | 浅黄 | 浅黄红 | 较浅黄色 | 接近无色 |
您最近一年使用:0次
名校
2 . 碲(Te)是半导体、红外探测等领域的重要战略元素。从阳极泥或冶炼烟尘中提取的粗二氧化碲中含有 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
(1)“浸出”步骤中,碲和硒两种元素分别转化为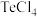 和
和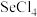 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是___________ 。
(2)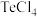 的沸点(387℃)高于
的沸点(387℃)高于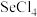 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是___________ 。
(3)“净化”步骤中产生的滤渣主要含___________ (写化学式)和少量硒单质。
(4)化学反应的吉布斯自由能变 。
。 还原
还原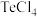 和
和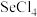 的
的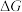 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过___________ K,该步骤控制在此温度以下的原因是___________ 。___________ 。
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是___________ (填标号)。
A.铁粉 B.氢气 C.硫化钠
 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。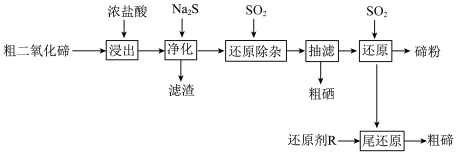
(1)“浸出”步骤中,碲和硒两种元素分别转化为
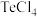 和
和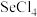 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是(2)
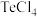 的沸点(387℃)高于
的沸点(387℃)高于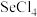 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是(3)“净化”步骤中产生的滤渣主要含
(4)化学反应的吉布斯自由能变
 。
。 还原
还原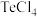 和
和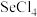 的
的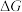 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过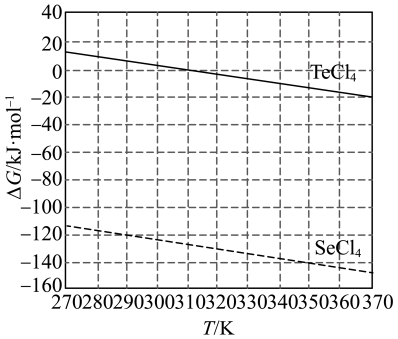
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是
A.铁粉 B.氢气 C.硫化钠
您最近一年使用:0次
2024-04-01更新
|
479次组卷
|
4卷引用:河南省周口市2024届高三二模理综-化学试题
河南省周口市2024届高三二模理综-化学试题河南省2024届高三下学期第二次质量检测(二模)理综-化学试卷2024届河南省许昌市禹州市高级中学高三下学期第三次专题考试理综试题-高中化学(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
3 . 零价铝是一种应用于环境修复的极有潜力的两性金属材料。构建微观腐蚀原电池体系(如图),实现了零价铝在近中性溶液中处理硝酸盐。下列叙述正确的是
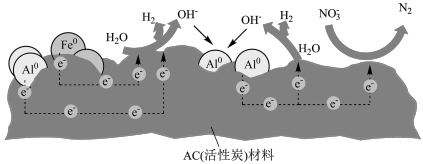
A. 在 在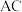 电极上发生氧化反应 电极上发生氧化反应 |
B.生成 的电极反应式: 的电极反应式: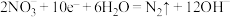 |
C.若 表面生成了致密的 表面生成了致密的 ,能提高去除率 ,能提高去除率 |
D.生成等物质的量的 和 和 ,转移的电子数之比为1∶5 ,转移的电子数之比为1∶5 |
您最近一年使用:0次
2024-03-30更新
|
615次组卷
|
5卷引用:河南省部分省示范高中2023-2024学年高三下学期3月联考理科综合试卷-高中化学
河南省部分省示范高中2023-2024学年高三下学期3月联考理科综合试卷-高中化学辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题贵州省安顺市部分学校2024届高三下学期二模考试化学试题(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
4 . 利用某废矿渣(主要成分为 ,还含有
,还含有 、
、 、
、 等杂质)提取高附加值的铁红(
等杂质)提取高附加值的铁红( )的一种工艺流程如图所示。
)的一种工艺流程如图所示。
(1)“酸浸”前一般需将废矿渣粉碎,其目的是___________ ,“浸渣”的主要成分为___________ (填化学式)。
(2)“还原”过程中发生反应的离子方程式为___________ ,可用___________ 检验是否还原完全。
(3)“净化”时若加入过量氨水,则会使 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为___________ ;“沉镍”过程中,当开始有沉淀析出时,溶液中的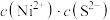 为一定值,数值约为
为一定值,数值约为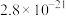 (室温),当溶液中
(室温),当溶液中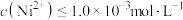 时可认为
时可认为 沉淀完全,试计算此时溶液中的
沉淀完全,试计算此时溶液中的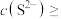
___________ 。
(4)“沉铁”所得“滤渣3”的成分为 ,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为
,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为___________ ;“煅烧”时,每得到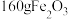 ,理论上消耗氧气(标准状况)的体积为
,理论上消耗氧气(标准状况)的体积为___________ 。
(5)铁红样品的纯度测定:
称取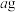 铁红样品,将样品溶于一定量的硫酸中,得到
铁红样品,将样品溶于一定量的硫酸中,得到 溶液,从中量取
溶液,从中量取 溶液进行如下实验:先加稍过量的
溶液进行如下实验:先加稍过量的 溶液,充分反应后,再向溶液中滴加
溶液,充分反应后,再向溶液中滴加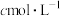 的
的 溶液,使
溶液,使 恰好转化为
恰好转化为 。三次平行实验所消耗
。三次平行实验所消耗 溶液的体积的平均值为
溶液的体积的平均值为 ,假设杂质始终未参加反应,则铁红样品的纯度为
,假设杂质始终未参加反应,则铁红样品的纯度为___________ %(用含 、
、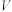 、
、 的表达式填写)。
的表达式填写)。
 ,还含有
,还含有 、
、 、
、 等杂质)提取高附加值的铁红(
等杂质)提取高附加值的铁红( )的一种工艺流程如图所示。
)的一种工艺流程如图所示。
(1)“酸浸”前一般需将废矿渣粉碎,其目的是
(2)“还原”过程中发生反应的离子方程式为
(3)“净化”时若加入过量氨水,则会使
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为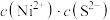 为一定值,数值约为
为一定值,数值约为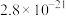 (室温),当溶液中
(室温),当溶液中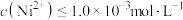 时可认为
时可认为 沉淀完全,试计算此时溶液中的
沉淀完全,试计算此时溶液中的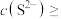
(4)“沉铁”所得“滤渣3”的成分为
 ,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为
,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为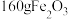 ,理论上消耗氧气(标准状况)的体积为
,理论上消耗氧气(标准状况)的体积为(5)铁红样品的纯度测定:
称取
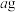 铁红样品,将样品溶于一定量的硫酸中,得到
铁红样品,将样品溶于一定量的硫酸中,得到 溶液,从中量取
溶液,从中量取 溶液进行如下实验:先加稍过量的
溶液进行如下实验:先加稍过量的 溶液,充分反应后,再向溶液中滴加
溶液,充分反应后,再向溶液中滴加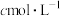 的
的 溶液,使
溶液,使 恰好转化为
恰好转化为 。三次平行实验所消耗
。三次平行实验所消耗 溶液的体积的平均值为
溶液的体积的平均值为 ,假设杂质始终未参加反应,则铁红样品的纯度为
,假设杂质始终未参加反应,则铁红样品的纯度为 、
、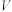 、
、 的表达式填写)。
的表达式填写)。
您最近一年使用:0次
2024-03-28更新
|
130次组卷
|
3卷引用:河南省商丘市青桐鸣2023-2024学年高一下学期3月月考化学试题
名校
解题方法
5 . 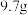 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,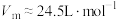 )。将生成的
)。将生成的 、
、 与
与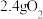 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是
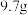 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,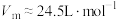 )。将生成的
)。将生成的 、
、 与
与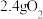 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是A.原合金中, 和 和 的物质的量之比为 的物质的量之比为 |
B.生成的混合气体甲的总质量为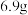 |
C.溶液乙中,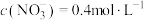 |
D.原硝酸溶液中含有 的物质的量为 的物质的量为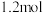 |
您最近一年使用:0次
2024-03-27更新
|
169次组卷
|
7卷引用:河南省创新发展联盟2023-2024学年高一下学期3月月考化学试题
名校
解题方法
6 . 中国科学院理化所发现利用Pd-CdS可使PLA(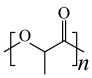 )转化为丙酮酸(
)转化为丙酮酸(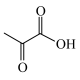 )的速率显著提高,并且优异的稳定性确保了Pd—CdS可以维持100h的反应性能,其反应机理如图所示,Pd-CdS在光照条件下产生带正电空穴(用h+表示,可捕获电子)和电子。下列说法错误的是
)的速率显著提高,并且优异的稳定性确保了Pd—CdS可以维持100h的反应性能,其反应机理如图所示,Pd-CdS在光照条件下产生带正电空穴(用h+表示,可捕获电子)和电子。下列说法错误的是
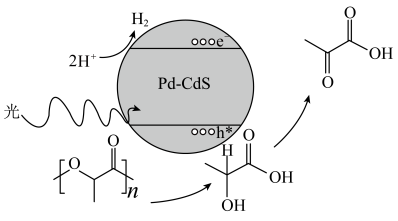
| A.Pd-CdS可作乳酸制备丙酮酸的催化剂 |
| B.在相同条件下,适当增加光的强度有利于加快反应速率 |
| C.整个过程中,氧化产物与还原产物的物质的量之比为1:1 |
| D.当180gPLA完全转化成丙酮酸时,理论上Pd-CdS中至少产生4molh+ |
您最近一年使用:0次
2024-03-27更新
|
628次组卷
|
3卷引用:2024届河南省信阳高级中学高三下学期模拟预测(十三)理综试题-高中化学
名校
7 . 二氧化碲( )是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为
)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为 ,还含有少量
,还含有少量 、
、 )为原料制备
)为原料制备 并获得海绵铜的工艺流程如图所示。
并获得海绵铜的工艺流程如图所示。 是不溶于水的固体;碱浸液的主要成分为
是不溶于水的固体;碱浸液的主要成分为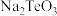 和
和 。
。
请回答下列问题:
(1) 的摩尔质量为
的摩尔质量为_________ ;浸渣b的主要成分为_________ (填化学式)。
(2)“氧化酸浸”时,为了加快反应速率,除将铜碲渣粉碎外,还可以采取的措施为_________ (写一种即可);配平该过程中发生反应的离子方程式:_______ 。
_____ _______
_______ _______
_______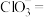 _______
_______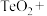 _______
_______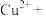 _______
_______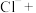 _______
_______ 。
。
若用稀硝酸代替 ,不足之处可能是
,不足之处可能是_________ 。
(3)“净化中和”时,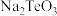 转化为
转化为 反应的化学方程式为
反应的化学方程式为__________________ ;实验室进行过滤操作时,需要用到主要成分为硅酸盐的仪器有烧杯、_____________ 。
(4)工业上制备的海绵铜中含有杂质 和
和 ,可以用__________(填标号)除去海绵铜中的杂质。
,可以用__________(填标号)除去海绵铜中的杂质。
 )是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为
)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为 ,还含有少量
,还含有少量 、
、 )为原料制备
)为原料制备 并获得海绵铜的工艺流程如图所示。
并获得海绵铜的工艺流程如图所示。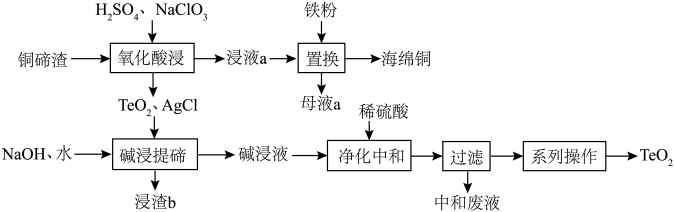
 是不溶于水的固体;碱浸液的主要成分为
是不溶于水的固体;碱浸液的主要成分为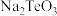 和
和 。
。请回答下列问题:
(1)
 的摩尔质量为
的摩尔质量为(2)“氧化酸浸”时,为了加快反应速率,除将铜碲渣粉碎外,还可以采取的措施为
_____
 _______
_______ _______
_______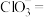 _______
_______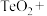 _______
_______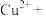 _______
_______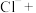 _______
_______ 。
。若用稀硝酸代替
 ,不足之处可能是
,不足之处可能是(3)“净化中和”时,
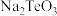 转化为
转化为 反应的化学方程式为
反应的化学方程式为(4)工业上制备的海绵铜中含有杂质
 和
和 ,可以用__________(填标号)除去海绵铜中的杂质。
,可以用__________(填标号)除去海绵铜中的杂质。| A.稀硝酸 | B.稀盐酸 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
2024-03-27更新
|
205次组卷
|
4卷引用:河南省创新发展联盟2023-2024学年高一下学期3月月考化学试题
8 . 综合利用软锰矿(主要含 ,还有少量
,还有少量 、
、 、MgO、CaO、
、MgO、CaO、 )和硫铁矿(主要含
)和硫铁矿(主要含 )回收
)回收 的工艺流程如图所示:
的工艺流程如图所示:
请回答下列问题:
(1)“酸浸”时将矿石粉碎,主要目的是___________ 。
(2)浸渣1中除 和S外,还有
和S外,还有___________ (填化学式)。S是 分别与
分别与 、
、 反应产生的,其中
反应产生的,其中 与
与 反应的离子方程式为
反应的离子方程式为___________
(3)当离子浓度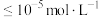 时,可视为沉淀完全,则“除铁铝”时应控制
时,可视为沉淀完全,则“除铁铝”时应控制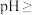
___________ (保留两位有效数字)。
(4)“氟化除杂”时除钙的离子反应的平衡常数
___________ (保留两位有效数字)。“转化”时发生反应的离子方程式为___________ 。
(5)氟化钙的晶胞结构如图所示: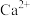 周围最近且距离相等的
周围最近且距离相等的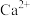 个数为
个数为___________ ,若晶体密度为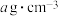 ,用
,用 表示阿伏加德罗常数的值,则晶体中
表示阿伏加德罗常数的值,则晶体中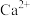 与
与 间的最近距离为
间的最近距离为___________ cm(用含 、
、 的代数式表示)。
的代数式表示)。
 ,还有少量
,还有少量 、
、 、MgO、CaO、
、MgO、CaO、 )和硫铁矿(主要含
)和硫铁矿(主要含 )回收
)回收 的工艺流程如图所示:
的工艺流程如图所示:
| 物质 |  | 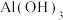 |  | 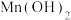 | 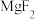 |  | 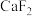 |
 | 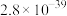 | 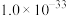 | 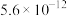 | 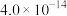 | 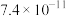 | 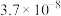 | 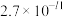 |
(1)“酸浸”时将矿石粉碎,主要目的是
(2)浸渣1中除
 和S外,还有
和S外,还有 分别与
分别与 、
、 反应产生的,其中
反应产生的,其中 与
与 反应的离子方程式为
反应的离子方程式为(3)当离子浓度
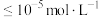 时,可视为沉淀完全,则“除铁铝”时应控制
时,可视为沉淀完全,则“除铁铝”时应控制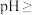
(4)“氟化除杂”时除钙的离子反应的平衡常数

(5)氟化钙的晶胞结构如图所示:
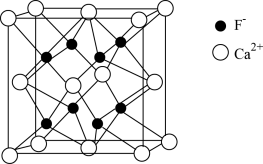
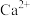 周围最近且距离相等的
周围最近且距离相等的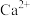 个数为
个数为 ,用
,用 表示阿伏加德罗常数的值,则晶体中
表示阿伏加德罗常数的值,则晶体中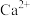 与
与 间的最近距离为
间的最近距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-03-26更新
|
391次组卷
|
3卷引用:2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学
2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学2024届河南省禹州市高级中学高三下学期综合考试(1)理综试题-高中化学(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
9 . 按要求完成下面小题。
(1)有以下转化关系:
反应①:___________
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是___________ (填序号)。
(2) 。该反应中,生成物M是
。该反应中,生成物M是___________ (填化学式)。
(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是___________ (填序号,下同)。
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为___________ 。
(5) 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:___________ 。
(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平___________ 。
(1)有以下转化关系:

反应①:
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是(2)
 。该反应中,生成物M是
。该反应中,生成物M是(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为
(5)
 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平
您最近一年使用:0次
2024-03-25更新
|
94次组卷
|
2卷引用:河南省洛阳市宜阳县第一高级中学2023-2024学年高一下学期期中考试化学试卷(研学班)
10 . 郫县豆瓣是中国有名调味料之一。某罐装郫县豆瓣部分信息如图所示。下列有关说法正确的是
| 配料表:红辣椒、蚕豆、食用盐、小麦粉、菜籽油、香辛料、食品添加剂(山梨酸钾)、 食用盐(NaCl计)含量:16~18g/100g 净含量:500g |
| A.郫县豆瓣能产生丁达尔效应 |
| B.制作过程中需要发酵,发酵时未发生化学反应 |
| C.郫县豆瓣密封保存的原因之一是隔绝空气中的氮气 |
| D.每500g该郫县豆瓣中含有NaCl的物质的量最多约为1.54mol |
您最近一年使用:0次



