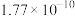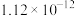名校
1 . 从海带浸泡液(碘元素主要以 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。 的作用为
的作用为_______ (填“氧化剂”或“还原剂”)。
(2)为提高①的化学反应速率,可采取的措施是_______ (写出一条即可)。
(3)补全②的离子方程式:_______ 。
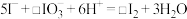
(4)②中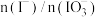 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。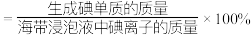
分析图中信息,选择最佳条件:_______ 。
 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。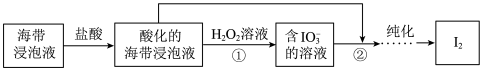
 的作用为
的作用为(2)为提高①的化学反应速率,可采取的措施是
(3)补全②的离子方程式:
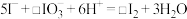
(4)②中
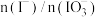 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。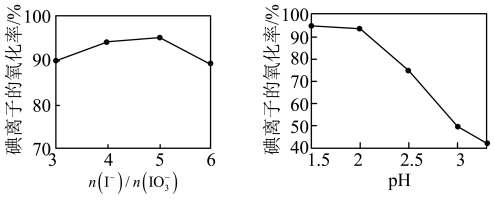
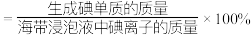
分析图中信息,选择最佳条件:
您最近一年使用:0次
2024-05-22更新
|
161次组卷
|
2卷引用:河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期6月月考化学试题
解题方法
2 .  是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以
是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以 、木炭和
、木炭和 为原料制备
为原料制备 的装置如图(夹持装置略)。
的装置如图(夹持装置略)。 的制备
的制备
(ⅰ)连接仪器,检验装置的气密性,盛装药品;(ⅱ)打开 ,……(ⅲ)打开
,……(ⅲ)打开 ,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:
,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:
(1)操作(ⅱ)的后续操作为________________ 。
(2)装置D的产物均为有毒化合物,则该反应的化学方程式为________________ ;判断该反应结束的实验现象是________________ 。
(3)A中反应结束后,再通入适量 的目的是
的目的是________________ ;图示装置存在的两处缺陷是________________ 。
Ⅱ. 含量的测定
含量的测定
将m g样品的水解液配成 溶液,取
溶液,取 于锥形瓶中,滴加2~3滴
于锥形瓶中,滴加2~3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液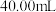 。
。
已知:
(4)该产品纯度为________ 。
(5)下列实验操作会导致产品纯度测定结果偏低的有________(填字母)。
 是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以
是生产金属钛及其化合物的重要中间体,常温下为液体且有毒,暴露在空气中会发烟,极易水解。模拟工业上以 、木炭和
、木炭和 为原料制备
为原料制备 的装置如图(夹持装置略)。
的装置如图(夹持装置略)。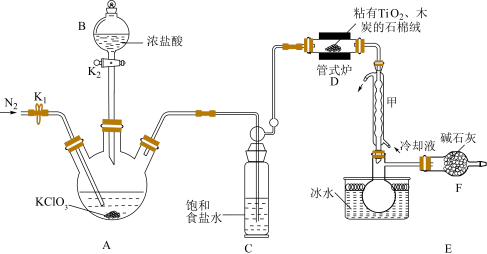
 的制备
的制备(ⅰ)连接仪器,检验装置的气密性,盛装药品;(ⅱ)打开
 ,……(ⅲ)打开
,……(ⅲ)打开 ,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:
,加入适量浓盐酸,接通冷凝装置,加热管式炉开始反应。回答下列问题:(1)操作(ⅱ)的后续操作为
(2)装置D的产物均为有毒化合物,则该反应的化学方程式为
(3)A中反应结束后,再通入适量
 的目的是
的目的是Ⅱ.
 含量的测定
含量的测定将m g样品的水解液配成
 溶液,取
溶液,取 于锥形瓶中,滴加2~3滴
于锥形瓶中,滴加2~3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液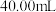 。
。已知:
难溶物 |
|
|
颜色 | 白 | 砖红 |
|
|
|
(4)该产品纯度为
(5)下列实验操作会导致产品纯度测定结果偏低的有________(填字母)。
| A.用待测液润洗锥形瓶 | B.样品暴露在空气中时间较长 |
| C.滴定终点时仰视读数 | D.滴加指示剂的量过多 |
您最近一年使用:0次
解题方法
3 . 中华文化博大精深,蕴含着丰富且深邃的化学知识。下列说法正确的是
| A.“凡石灰经火焚炼为用”,其反应原理可用于制备生石灰 |
B.“高奴县有洧水可燃”,“洧水”完全燃烧的产物只有 和 和 |
C.“曾青涂铁,铁赤如铜”,涉及的反应能证明氧化性: |
| D.“有硒水者,剪银塊投之,则旋而为水”,“硒水”在实验室中保存在无色瓶中 |
您最近一年使用:0次
解题方法
4 . 硫脲 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.
(1)仪器a的名称为__________ ;试剂X为__________ 。
(2)关闭 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为__________ 。
(3)关闭 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是__________ 。
(4)关闭 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为__________ ;为减少氧化,减压过滤和干燥时最好采用的仪器是__________ 。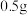 产品配成
产品配成 溶液,取
溶液,取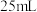 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和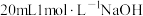 溶液,发生反应:
溶液,发生反应: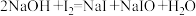 ;
;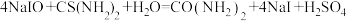 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用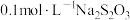 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: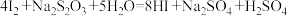 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为__________ ;粗产品中硫脲的质量分数为__________ (用含V的代数式表示)。
 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.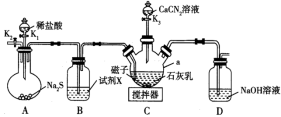
(1)仪器a的名称为
(2)关闭
 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为(3)关闭
 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是(4)关闭
 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为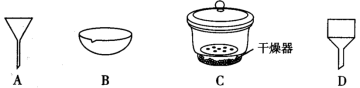
 产品配成
产品配成 溶液,取
溶液,取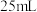 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和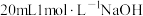 溶液,发生反应:
溶液,发生反应: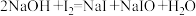 ;
;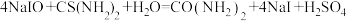 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用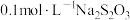 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: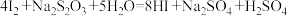 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为
您最近一年使用:0次
5 . 磷酸铁锂前驱体磷酸铁是一种重要的化工原料,被广泛用于汽车电池。用浓硫酸浸取钛铁矿(主要成分为 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:___________ 。
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若 ,会导致
,会导致___________ ;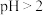 ,会导致
,会导致___________ 。
(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是___________ 。将滤液收集用于溶解步骤,其目的是___________ (答出两条即可)。
(4)在该流程中,以 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为___________ 。
(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为___________ 。 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为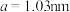 、
、 、
、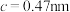 ,
, 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下: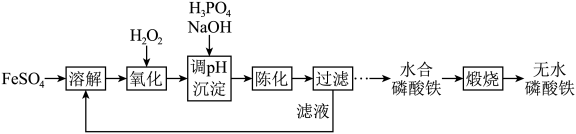
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若
 ,会导致
,会导致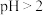 ,会导致
,会导致(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是
(4)在该流程中,以
 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为

 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为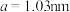 、
、 、
、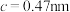 ,
, 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。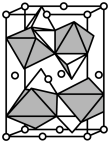
您最近一年使用:0次
2024-05-14更新
|
80次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
解题方法
6 . 下列反应不符合哲学中“量变引起质变”观点的是
| A.锌与硫酸 | B.FeBr2溶液和氯水 |
| C.铜和硝酸 | D.氨气和氯化氢 |
您最近一年使用:0次
解题方法
7 . 澳大利亚昆士兰大学的王连洲教授团队设计了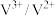 离子对作为氧化还原电子对提升
离子对作为氧化还原电子对提升 和
和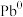 之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
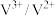 离子对作为氧化还原电子对提升
离子对作为氧化还原电子对提升 和
和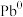 之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是
之间的氧化还原反应能力(如图所示,依次发生反应1和反应2),从而加速Sn-Pb钙钛矿在工作状态下的自修复效应。下列叙述正确的是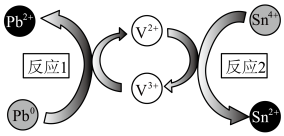
A.总反应为 | B.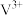 为中间产物, 为中间产物, 为催化剂 为催化剂 |
C.氧化性: | D.反应2中负极反应: |
您最近一年使用:0次
名校
解题方法
8 . 镍的氧化物M是蓄电池材料。某小组用含镍废料(成分为NiO、Ni2O3、FeO、MgO和SiO2等)制备M的工艺流程如图所示。
(1)固体2的主要成分是_______ (填化学式)。提高“酸浸”速率宜采用的措施有_______ (答两条)。
(2)“酸浸”中有无色无味且有助燃性的气体产生,该过程中发生反应的离子方程式为_______ 。
(3)已知: ,
, 。若浸出液中
。若浸出液中 ,当离子浓度
,当离子浓度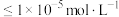 时认为已完全沉淀。用Na2CO3调节pH范围为
时认为已完全沉淀。用Na2CO3调节pH范围为_______ 。
(4)“系列操作”包括蒸发浓缩、_______ 、过滤、乙醇洗涤、干燥。用乙醇洗涤的目的是_______ 。
(5)灼烧NiSO4•7H2O时,剩余固体的质量与温度的变化关系如图1所示。_______ 。
(6)Nb和Ni组成合金,晶胞如图2所示。设 为阿伏加德罗常数的值。该晶胞密度为
为阿伏加德罗常数的值。该晶胞密度为_______  (只列计算式)。
(只列计算式)。

(1)固体2的主要成分是
(2)“酸浸”中有无色无味且有助燃性的气体产生,该过程中发生反应的离子方程式为
(3)已知:
 ,
, 。若浸出液中
。若浸出液中 ,当离子浓度
,当离子浓度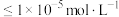 时认为已完全沉淀。用Na2CO3调节pH范围为
时认为已完全沉淀。用Na2CO3调节pH范围为(4)“系列操作”包括蒸发浓缩、
(5)灼烧NiSO4•7H2O时,剩余固体的质量与温度的变化关系如图1所示。

(6)Nb和Ni组成合金,晶胞如图2所示。设
 为阿伏加德罗常数的值。该晶胞密度为
为阿伏加德罗常数的值。该晶胞密度为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
2024-05-06更新
|
69次组卷
|
3卷引用:2024届河南省名校高三下学期压轴卷(1)理综试卷-高中化学
名校
解题方法
9 . 锰在汽车电池、高端装备制造、新材料等领域有广泛应用。利用软锰矿(主要成分为 ,含
,含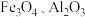 等杂质)和黄铁矿(主要成分为
等杂质)和黄铁矿(主要成分为 )联合制备绿矾和高纯
)联合制备绿矾和高纯 ,并用所得
,并用所得 制备
制备 的工艺流程如下:
的工艺流程如下: 如下:
如下:
回答下列问题:
(1)将软锰矿和黄铁矿“粉碎”,并用水调至糊状的目的是______ 。“浸渣”中除了含有不溶于酸的杂质外,还含有生成的单质 ,则“酸浸”时发生的主要反应的离子方程式为
,则“酸浸”时发生的主要反应的离子方程式为______ 。
(2)常温下, 的溶度积
的溶度积
______ 。“调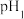 ”的范围为
”的范围为______ 。
(3)“沉锰”时,溶液的 、反应时间与
、反应时间与 的产率的关系如图1所示。“沉锰”时,应调节溶液的
的产率的关系如图1所示。“沉锰”时,应调节溶液的 为
为______ 。“沉锰”反应的离子方程式为______ 。______ 。
(5)“电解”制取金属锰的化学方程式为______ 。
(6)铜、钛和锰、铁都是第四周期的过渡元素。一种含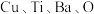 四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为
四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为 ),该晶体的密度为
),该晶体的密度为______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含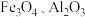 等杂质)和黄铁矿(主要成分为
等杂质)和黄铁矿(主要成分为 )联合制备绿矾和高纯
)联合制备绿矾和高纯 ,并用所得
,并用所得 制备
制备 的工艺流程如下:
的工艺流程如下: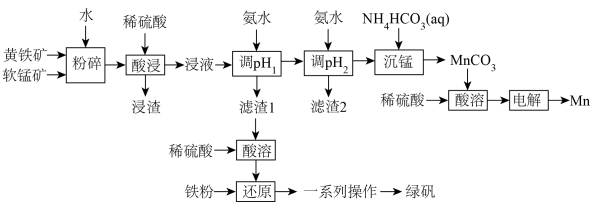
 如下:
如下:| 金属离子 |  |  |  |  |
| 开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全 的 的 | 10.1 | 8.3 | 2.8 | 4.7 |
(1)将软锰矿和黄铁矿“粉碎”,并用水调至糊状的目的是
 ,则“酸浸”时发生的主要反应的离子方程式为
,则“酸浸”时发生的主要反应的离子方程式为(2)常温下,
 的溶度积
的溶度积
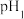 ”的范围为
”的范围为(3)“沉锰”时,溶液的
 、反应时间与
、反应时间与 的产率的关系如图1所示。“沉锰”时,应调节溶液的
的产率的关系如图1所示。“沉锰”时,应调节溶液的 为
为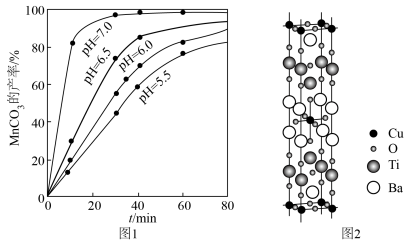
(5)“电解”制取金属锰的化学方程式为
(6)铜、钛和锰、铁都是第四周期的过渡元素。一种含
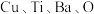 四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为
四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为 ),该晶体的密度为
),该晶体的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
10 . 已知FeSO4有如图所示的转化关系,下列叙述正确的是

| A.M一定是红棕色粉末 |
| B.图中发生了3个氧化还原反应 |
| C.生成HNO3的反应中,浓硫酸表现强氧化性、难挥发性和强酸性 |
D.“褪色”的原因是SO2+Br2+2H2O=4H++ +2Br- +2Br- |
您最近一年使用:0次