名校
1 . 稀土元素被誉为“现代工业的维生素”和“21世纪新材料宝库”,广泛应用于新材料、冶金化工、电子信息、节能环保等领域,由普通级氯化镧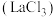 料液制备高纯氧化铜
料液制备高纯氧化铜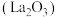 的新工艺流程如图所示。
的新工艺流程如图所示。 太高,EDTA和
太高,EDTA和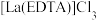 会结晶沉淀。
会结晶沉淀。
回答下列问题:
(1)普通级氯化镧料液中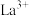 通过树脂
通过树脂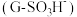 时,在树脂吸附柱上发生反应生成
时,在树脂吸附柱上发生反应生成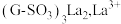 被吸附在树脂内部,反应的离子方程式为
被吸附在树脂内部,反应的离子方程式为________ 。
(2)经氨水处理过的淋洗液,再经 淋洗,发生反应
淋洗,发生反应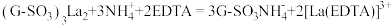 ,淋洗液的
,淋洗液的 对分离效率的影响如图所示。则淋洗时,淋洗液的
对分离效率的影响如图所示。则淋洗时,淋洗液的 应调到
应调到
__________ 。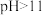 时,分离效率就迅速下降,原因是
时,分离效率就迅速下降,原因是____________ 。
(4)用草酸溶液将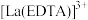 中的
中的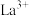 沉淀出来,最后进行高温焙烧。在空气中高温焙烧
沉淀出来,最后进行高温焙烧。在空气中高温焙烧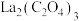 ,若空气中氧气的体积分数为
,若空气中氧气的体积分数为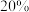 ,则消耗的空气与高温焙烧生成的
,则消耗的空气与高温焙烧生成的 的物质的量之比为
的物质的量之比为__________ 。
(5)锶镧铜氧化物超导体的晶胞结构(底面是正方形的长方体)如图所示,晶胞中锶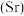 原子与镧
原子与镧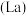 原子的个数比为
原子的个数比为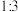 ,体心与顶点的
,体心与顶点的 原子有着相同的化学环境,
原子有着相同的化学环境, 原子1的分数坐标为
原子1的分数坐标为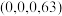 。则该超导体的化学式为
。则该超导体的化学式为__________ ,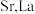 原子2的分数坐标为
原子2的分数坐标为__________ ,体心 原子与
原子与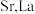 原子之间的最近距离为
原子之间的最近距离为__________  (列出含a、c的计算式)。
(列出含a、c的计算式)。
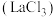 料液制备高纯氧化铜
料液制备高纯氧化铜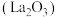 的新工艺流程如图所示。
的新工艺流程如图所示。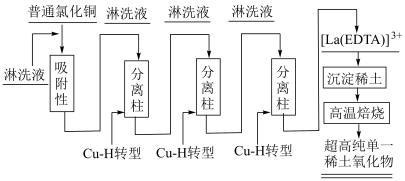
 太高,EDTA和
太高,EDTA和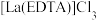 会结晶沉淀。
会结晶沉淀。回答下列问题:
(1)普通级氯化镧料液中
 通过树脂
通过树脂 时,在树脂吸附柱上发生反应生成
时,在树脂吸附柱上发生反应生成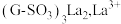 被吸附在树脂内部,反应的离子方程式为
被吸附在树脂内部,反应的离子方程式为(2)经氨水处理过的淋洗液,再经
 淋洗,发生反应
淋洗,发生反应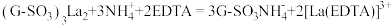 ,淋洗液的
,淋洗液的 对分离效率的影响如图所示。则淋洗时,淋洗液的
对分离效率的影响如图所示。则淋洗时,淋洗液的 应调到
应调到

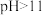 时,分离效率就迅速下降,原因是
时,分离效率就迅速下降,原因是(4)用草酸溶液将
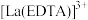 中的
中的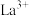 沉淀出来,最后进行高温焙烧。在空气中高温焙烧
沉淀出来,最后进行高温焙烧。在空气中高温焙烧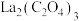 ,若空气中氧气的体积分数为
,若空气中氧气的体积分数为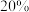 ,则消耗的空气与高温焙烧生成的
,则消耗的空气与高温焙烧生成的 的物质的量之比为
的物质的量之比为(5)锶镧铜氧化物超导体的晶胞结构(底面是正方形的长方体)如图所示,晶胞中锶
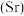 原子与镧
原子与镧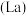 原子的个数比为
原子的个数比为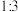 ,体心与顶点的
,体心与顶点的 原子有着相同的化学环境,
原子有着相同的化学环境, 原子1的分数坐标为
原子1的分数坐标为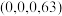 。则该超导体的化学式为
。则该超导体的化学式为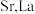 原子2的分数坐标为
原子2的分数坐标为 原子与
原子与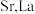 原子之间的最近距离为
原子之间的最近距离为 (列出含a、c的计算式)。
(列出含a、c的计算式)。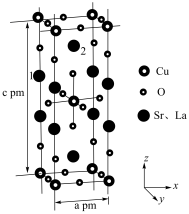
您最近一年使用:0次
2024-03-22更新
|
393次组卷
|
3卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
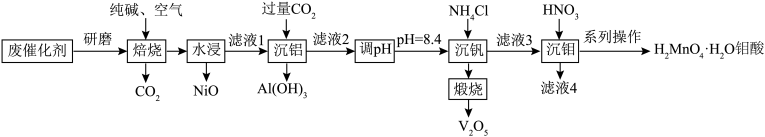
2 . 钒和钼是贵重金属,一种从石油炼制的废催化剂(主要成分为MoS2、NiS、V2O5、Al2O3等)中提取钒和钼的工艺流程如图所示。 、MoO
、MoO 、VO
、VO 、[Al(OH)4]-、
、[Al(OH)4]-、 。
。
②常温下,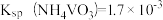 。
。
回答下列问题:
(1)V在元素周期表中的位置为_____ ;H2MoO4·H2O中钼元素的化合价为_____ 。
(2)在“焙烧”过程中MoS2参与的反应中还原剂与氧化剂的物质的量之比为_____ ;若在实验室中完成“焙烧”,应选择_____ (填“石英”或“铁”)坩埚。
(3)写出“沉铝”时生成Al(OH)3的离子方程式:_____ 。
(4)若“沉钒”前溶液中c(VO )=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(
)=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c( )=
)=_____ mol·L-1(忽略溶液体积变化)。
(5)一种钒的硫化物的晶体结构(图1)及其俯视图(图2)如图所示:_____ 。
②设阿伏加德罗常数的值为NA,则该晶体的密度为_____ g·cm-3(用含a、b、NA的代数式表示)。
 、MoO
、MoO 、VO
、VO 、[Al(OH)4]-、
、[Al(OH)4]-、 。
。②常温下,
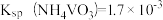 。
。回答下列问题:
(1)V在元素周期表中的位置为
(2)在“焙烧”过程中MoS2参与的反应中还原剂与氧化剂的物质的量之比为
(3)写出“沉铝”时生成Al(OH)3的离子方程式:
(4)若“沉钒”前溶液中c(VO
 )=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(
)=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c( )=
)=(5)一种钒的硫化物的晶体结构(图1)及其俯视图(图2)如图所示:

②设阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
名校
3 . NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为_____ 。
(2)装置C的目的是_____ 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为_____ 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是_____ 。
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是 ;
;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是 ;。
;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的_____ 溶液(填化学式,下同)和0.1mol·L-1_____ 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是_____ %(结果保留三位有效数字)。下列操作使测得的NH4CuSO3质量分数偏大的为_____ (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为
(2)装置C的目的是
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是
 ;
;猜想ⅱ:乙同学认为使品红褪色的微粒主要是
 ;。
;。为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的
(6)测定产品中
 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
您最近一年使用:0次
2024·北京·模拟预测
名校
解题方法
4 . 分析含有少量NaOH的NaClO溶液与FeSO4溶液的反应。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
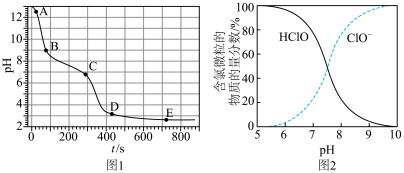
A.A点溶液的pH约为13,主要原因是ClO− + H2O HClO + OH− HClO + OH− |
| B.AB段pH显著下降的原因是5ClO-+2Fe2+ + 5H2O=Cl−+ 2Fe(OH)3↓+ 4HClO |
| C.CD段较BC段pH下降快的主要原因是HClO+2Fe2+ +5H2O=2Fe(OH)3↓+Cl-+ 5H+ |
| D.反应进行至400s时溶液中产生Cl2的原因是:ClO-+ Cl-+2H+=Cl2↑+ H2O |
您最近一年使用:0次
2024-03-19更新
|
609次组卷
|
6卷引用:2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学
2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学河南省信阳高级中学2023-2024学年高三测试(十六)理科综合试题-高中化学(已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题北京市顺义牛栏山第一中学2023-2024学年高二下学期4月月考化学试题(已下线)压轴题01?离子方程式与离子共存的判断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
5 . 某同学在实验室以铁镁矿渣(含 、
、 、
、 及少量
及少量 )和
)和 (常温下为液体)为原料制备
(常温下为液体)为原料制备 和
和 的流程如下:
的流程如下:

回答下列问题:
(1)“水解”反应的化学方程式为_______ 。
(2)“滤渣”为_______ (填化学式),其用途为_______ (填一条)。
(3)“氧化”的目的是_______ (用离子方程式表示)。
(4)“调 ”时,
”时, 调节至3,该工艺条件下,
调节至3,该工艺条件下,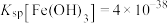 、
、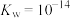 。
。
①为了获得更多的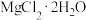 ,试剂X可以是
,试剂X可以是_______ (填化学式)。
②“调 ”后的溶液中
”后的溶液中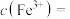
_______  。
。
(5)“系列操作”包括_______ ,过滤、洗涤、低温干燥。
(6)若直接加热蒸发 溶液
溶液____ (填“能”或“不能”)获得氯化镁晶体,其原因是_____ 。
 、
、 、
、 及少量
及少量 )和
)和 (常温下为液体)为原料制备
(常温下为液体)为原料制备 和
和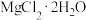 的流程如下:
的流程如下:
回答下列问题:
(1)“水解”反应的化学方程式为
(2)“滤渣”为
(3)“氧化”的目的是
(4)“调
 ”时,
”时, 调节至3,该工艺条件下,
调节至3,该工艺条件下,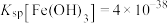 、
、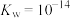 。
。①为了获得更多的
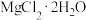 ,试剂X可以是
,试剂X可以是②“调
 ”后的溶液中
”后的溶液中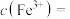
 。
。(5)“系列操作”包括
(6)若直接加热蒸发
 溶液
溶液
您最近一年使用:0次
6 . 工业原料粗氯铂酸铵[ ,黄色,难溶于水,易溶于盐酸]中含有大量
,黄色,难溶于水,易溶于盐酸]中含有大量 、
、 ,某同学设计实验制备海绵铂,步骤如下:
,某同学设计实验制备海绵铂,步骤如下:
步骤1:取适量样品于小烧杯中,加入蒸馏水洗涤、过滤,收集滤渣;
步骤2:向“步骤1”的滤渣中加入稀盐酸,固体溶解后加入水合肼 ,搅拌,充分反应生成易溶于水的氯亚铂酸铵
,搅拌,充分反应生成易溶于水的氯亚铂酸铵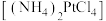 ;
;
步骤3:向“步骤2”所得溶液中通入足量 ,过滤洗涤得到
,过滤洗涤得到 ;
;
步骤4:充分煅烧 获得海绵铂。
获得海绵铂。
回答下列问题:
(1)“步骤1”洗涤时所用到的玻璃仪器有烧杯、漏斗、_______ ,该步骤的目的是_______ ,证明 已洗涤干净的具体操作为
已洗涤干净的具体操作为_______ 。
(2)“步骤2”在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对海绵铂的产率均有较大影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示。
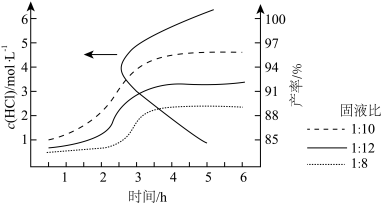
①由图1可得最佳反应条件是反应时间2.5~3h、_______ (填字母)。
A.酸度 、固液比
、固液比 B.酸度
B.酸度 、固液比
、固液比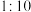
C.酸度 、固液比
、固液比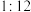 D.酸度
D.酸度 、固液比
、固液比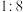
② 转化为
转化为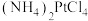 反应的化学方程式为
反应的化学方程式为_______ (还有 、
、 、
、 、
、 生成,不考虑水合肼自身分解)。
生成,不考虑水合肼自身分解)。
(3)步骤3所用装置(部分夹持仪器已省略)如图所示。

①装置a的烧瓶中盛放的固体为_______ (填化学式)。
②装置b中生成 的化学方程式为
的化学方程式为_______ 。
③选择下列装置吸收尾气,宜选择_______ (填字母)。
A.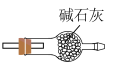 B.
B.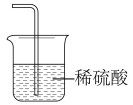 C.
C.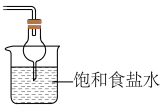 D.
D.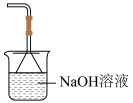
 ,黄色,难溶于水,易溶于盐酸]中含有大量
,黄色,难溶于水,易溶于盐酸]中含有大量 、
、 ,某同学设计实验制备海绵铂,步骤如下:
,某同学设计实验制备海绵铂,步骤如下:步骤1:取适量样品于小烧杯中,加入蒸馏水洗涤、过滤,收集滤渣;
步骤2:向“步骤1”的滤渣中加入稀盐酸,固体溶解后加入水合肼
 ,搅拌,充分反应生成易溶于水的氯亚铂酸铵
,搅拌,充分反应生成易溶于水的氯亚铂酸铵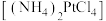 ;
;步骤3:向“步骤2”所得溶液中通入足量
 ,过滤洗涤得到
,过滤洗涤得到 ;
;步骤4:充分煅烧
 获得海绵铂。
获得海绵铂。回答下列问题:
(1)“步骤1”洗涤时所用到的玻璃仪器有烧杯、漏斗、
 已洗涤干净的具体操作为
已洗涤干净的具体操作为(2)“步骤2”在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对海绵铂的产率均有较大影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示。

①由图1可得最佳反应条件是反应时间2.5~3h、
A.酸度
 、固液比
、固液比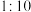 B.酸度
B.酸度 、固液比
、固液比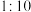
C.酸度
 、固液比
、固液比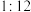 D.酸度
D.酸度 、固液比
、固液比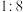
②
 转化为
转化为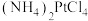 反应的化学方程式为
反应的化学方程式为 、
、 、
、 、
、 生成,不考虑水合肼自身分解)。
生成,不考虑水合肼自身分解)。(3)步骤3所用装置(部分夹持仪器已省略)如图所示。

①装置a的烧瓶中盛放的固体为
②装置b中生成
 的化学方程式为
的化学方程式为③选择下列装置吸收尾气,宜选择
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
7 . 写出下列所对应的离子或化学方程式
(1)写出用氯化铁溶液蚀刻印刷电路板发生反应的离子方程式:___________ 。
(2)向FeSO4溶液中滴加少量酸性KMnO4溶液,若溶液紫红色褪去,证明Fe2+具有还原性。反应原理用离子方程式表示为___________ 。
(3)写出泡沫灭火器的工作原理(AlCl3与NaHCO3反应):___________ 。
(4)写出Na2O2与CO2的反应,并标出双线桥___________ 。
(1)写出用氯化铁溶液蚀刻印刷电路板发生反应的离子方程式:
(2)向FeSO4溶液中滴加少量酸性KMnO4溶液,若溶液紫红色褪去,证明Fe2+具有还原性。反应原理用离子方程式表示为
(3)写出泡沫灭火器的工作原理(AlCl3与NaHCO3反应):
(4)写出Na2O2与CO2的反应,并标出双线桥
您最近一年使用:0次
解题方法
8 . 高铁酸钾 是一种暗紫色固体,在强碱性溶液中稳定,但在
是一种暗紫色固体,在强碱性溶液中稳定,但在 催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量
催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量 、
、 等)制备高铁酸钾的工艺流程如图所示:
等)制备高铁酸钾的工艺流程如图所示:
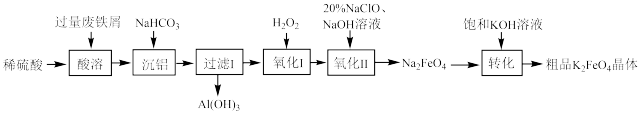
(1) 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),其中铁元素的化合价为___________ 价。
(2)加入 的目的是调节pH除铝,同时有气体生成,反应的离子方程式为
的目的是调节pH除铝,同时有气体生成,反应的离子方程式为________ 。
(3)“氧化I”发生反应的离子方程式为___________ 。
(4)“氧化Ⅱ”过程中每生成1mol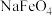 转移
转移___________ mol电子。
(5)水处理时,加入 作为净水消毒剂,发生反应的化学方程式为
作为净水消毒剂,发生反应的化学方程式为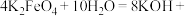
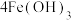 (胶体)
(胶体)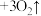 。
。 能用于消毒净水的原因是
能用于消毒净水的原因是___________ 。
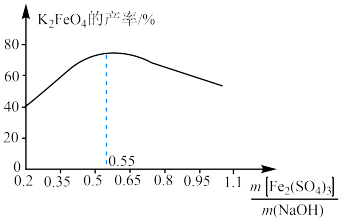
(6)在控制其他条件不变的情况下,改变 和NaOH的质量比对
和NaOH的质量比对 产率的影响如图所示,当二者质量比大于0.55时,随
产率的影响如图所示,当二者质量比大于0.55时,随 增大,
增大, 的产率下降的原因可能是
的产率下降的原因可能是___________ 。
(7)向 溶液中滴加
溶液中滴加 盐酸,产生黄绿色气体,说明
盐酸,产生黄绿色气体,说明 的氧化性
的氧化性________ (填“强”或“弱”)于 。另一种制备
。另一种制备 的反应原理为
的反应原理为 ,请分析
,请分析 和
和 的氧化性强弱关系相反的原因是
的氧化性强弱关系相反的原因是___________ 。
 是一种暗紫色固体,在强碱性溶液中稳定,但在
是一种暗紫色固体,在强碱性溶液中稳定,但在 催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量
催化作用下会发生分解反应,常用作水处理剂。某兴趣小组利用废铁屑(含少量 、
、 等)制备高铁酸钾的工艺流程如图所示:
等)制备高铁酸钾的工艺流程如图所示:
(1)
 属于
属于(2)加入
 的目的是调节pH除铝,同时有气体生成,反应的离子方程式为
的目的是调节pH除铝,同时有气体生成,反应的离子方程式为(3)“氧化I”发生反应的离子方程式为
(4)“氧化Ⅱ”过程中每生成1mol
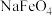 转移
转移(5)水处理时,加入
 作为净水消毒剂,发生反应的化学方程式为
作为净水消毒剂,发生反应的化学方程式为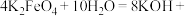
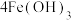 (胶体)
(胶体)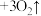 。
。 能用于消毒净水的原因是
能用于消毒净水的原因是(6)在控制其他条件不变的情况下,改变
 和NaOH的质量比对
和NaOH的质量比对 产率的影响如图所示,当二者质量比大于0.55时,随
产率的影响如图所示,当二者质量比大于0.55时,随 增大,
增大, 的产率下降的原因可能是
的产率下降的原因可能是
(7)向
 溶液中滴加
溶液中滴加 盐酸,产生黄绿色气体,说明
盐酸,产生黄绿色气体,说明 的氧化性
的氧化性 。另一种制备
。另一种制备 的反应原理为
的反应原理为 ,请分析
,请分析 和
和 的氧化性强弱关系相反的原因是
的氧化性强弱关系相反的原因是
您最近一年使用:0次
9 . 写出下列反应中转移的电子数目。
(1)1molCl2和NaOH反应转移电子数_______ 。
(2)3molNO2和H2O反应转移电子数_______ 。
(1)1molCl2和NaOH反应转移电子数
(2)3molNO2和H2O反应转移电子数
您最近一年使用:0次
名校
解题方法
10 .  是高效安全灭菌消毒剂,部分性质如下:
是高效安全灭菌消毒剂,部分性质如下:
实验室可利用反应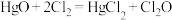 制取
制取 ,装置如图所示:
,装置如图所示:_______ 。
(2)装置①中制取氯气时需要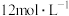 盐酸,若加入盐酸的体积是
盐酸,若加入盐酸的体积是 ,制取氯气的物质的量小于
,制取氯气的物质的量小于 ,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是
,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是_______ 。
(3)③中试剂的名称是_______ 。
(4)④中反应氧化剂和还原剂物质的量比值是_______ 。
(5)⑥中 与水反应制取
与水反应制取 ,反应的化学方程式是
,反应的化学方程式是_______ ; 中混有盐酸,原因是
中混有盐酸,原因是_______ (用化学方程式表示)。
(6)⑦中 溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是_______ 。
 是高效安全灭菌消毒剂,部分性质如下:
是高效安全灭菌消毒剂,部分性质如下:| 物理性质 | 化学性质 |
| 常温下,具有强烈刺激性气味的黄棕色气体 熔点:  ℃;沸点:3.8℃;42℃以上分解为 ℃;沸点:3.8℃;42℃以上分解为 和 和 。 。 | 强氧化性;与有机物、还原剂接触或浓度过高时会发生爆炸;易溶于水且会与水反应生成次氯酸 |
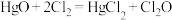 制取
制取 ,装置如图所示:
,装置如图所示: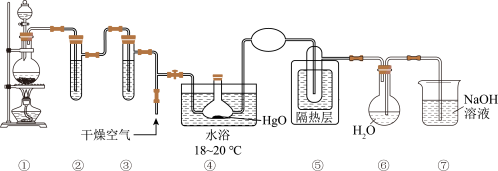
(2)装置①中制取氯气时需要
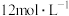 盐酸,若加入盐酸的体积是
盐酸,若加入盐酸的体积是 ,制取氯气的物质的量小于
,制取氯气的物质的量小于 ,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是
,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是(3)③中试剂的名称是
(4)④中反应氧化剂和还原剂物质的量比值是
(5)⑥中
 与水反应制取
与水反应制取 ,反应的化学方程式是
,反应的化学方程式是 中混有盐酸,原因是
中混有盐酸,原因是(6)⑦中
 溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
您最近一年使用:0次
2024-03-11更新
|
41次组卷
|
2卷引用:河南省洛阳市宜阳县第一高级中学2023-2024学年高一下学期期中考试化学试卷(研学班)



