名校
1 . 氮氧化合物和二氧化疏是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH 废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:

(1)SO2造成的一种常见的环境污染为_____ 。固体1的主要成分有Ca(OH)2、_____ 、_____ (填化学式)。
(2)气体1通入适量空气后,部分NO转化为NO2,写出NO转化为NO2的化学方程式_____ ,NO和NO2以物质的量之比为1:1通过NaOH溶液后只生成一种钠盐的化学方程式:_____ 。
(3)用NaNO2溶液处理含NH 的废水反应的离子方程式为
的废水反应的离子方程式为_____ ,气体3经过捕获剂捕获的污染性气体是______ (填化学式)。
(4)NO还可以被你NH3还原为N2而除去,如图是实验室常见气体的发生装置,实验室制备氨气可以选择B或C装置,如果选择B装置,则发生反应的化学方程式为:_____ ,如果选择C装置,则分液漏斗中盛装的物质为:_____ (写名称)。

(5)氨气是做喷泉实验的理想气体,如图是喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。则下列组合也能形成喷泉的是_____ (填字母序号)。
 废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
(1)SO2造成的一种常见的环境污染为
(2)气体1通入适量空气后,部分NO转化为NO2,写出NO转化为NO2的化学方程式
(3)用NaNO2溶液处理含NH
 的废水反应的离子方程式为
的废水反应的离子方程式为(4)NO还可以被你NH3还原为N2而除去,如图是实验室常见气体的发生装置,实验室制备氨气可以选择B或C装置,如果选择B装置,则发生反应的化学方程式为:

(5)氨气是做喷泉实验的理想气体,如图是喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。则下列组合也能形成喷泉的是

| A.HCl与水 | B.Cl2与饱和氯化钠溶液 |
| C.SO2与NaOH溶液 | D.CO2与水 |
您最近一年使用:0次
名校
解题方法
2 . 研究小组以 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂
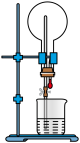
(1)无水 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。

①仪器a的名称为________ 。
②本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、________ 。
③反应管的温度升到660℃时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为________ 。 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是________ (填化学式)。
④反应管右端有15cm在加热炉外,其作用是________________ 。
(2) 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)

将制备的无水 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为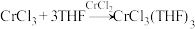 。
。
实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。
①锌粉的作用是________________ (用化学方程式表示)。
② 和
和 在THF的溶解性分别为
在THF的溶解性分别为________ 、________ (填“溶”或“不溶”)。
③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为________ %。[已知: 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂(1)无水
 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。
①仪器a的名称为
②本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、③反应管的温度升到660℃时发生反应,生成
 和
和 (光气),其化学方程式为
(光气),其化学方程式为 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是④反应管右端有15cm在加热炉外,其作用是
(2)
 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)
将制备的无水
 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为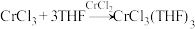 。
。实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与
 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。①锌粉的作用是
②
 和
和 在THF的溶解性分别为
在THF的溶解性分别为③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为
 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
您最近一年使用:0次
2023-03-14更新
|
700次组卷
|
4卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第五次月考理科综合试题
3 . 中国古代典籍中很多描述与化学知识紧密相关,下列有关说法合理的是
| A.《望庐山瀑布》诗句“日照香炉生紫烟”中,涉及到了金属元素的焰色反应 |
B.医学典籍《新修本草》中关于“青矾”的描述:“本来绿色,…,烧之赤色…”。“青矾”的主要成分是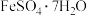 ,属于盐 ,属于盐 |
C.北宋名画《千里江山图》用到了一种矿物颜料“石青”——[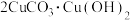 ]。“石青”既耐酸碱腐蚀又耐高温 ]。“石青”既耐酸碱腐蚀又耐高温 |
| D.屠呦呦从《肘后备急方》中发现青蒿素:“青蒿一握,以水二升渍,绞取汁…”此过程中发生了氧化还原反应 |
您最近一年使用:0次
名校
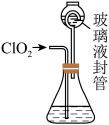
4 . 利用如图装置测定ClO2气体的质量:在锥形瓶中加入足量的KI溶液,再加入3 mL硫酸溶液:在玻璃液封管中加入水:将生成的ClO2气体通进入锥形瓶中被吸收;将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至终点时消耗V mL( )。下列说法错误的是
)。下列说法错误的是
 )。下列说法错误的是
)。下列说法错误的是 
A. 与酸化的KI溶液反应为 与酸化的KI溶液反应为 |
B.玻璃液封管的作用是吸收残余的 气体、使锥形瓶内外压强相等 气体、使锥形瓶内外压强相等 |
C.测得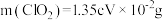 |
| D.滴定终点的现象是溶液由无色恰好变为蓝色,且半分钟内不变色 |
您最近一年使用:0次
2023-02-11更新
|
262次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
5 . 氧化还原反应在生产、生活中有广泛的用途。
Ⅰ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。回答下列问题:
(1)该反应中,氧化剂是_______ (填化学式,下同),还原剂是_______ ,氧化产物和还原产物的个数比是_______ 。
Ⅱ.工业废水中含有的重铬酸根离子( )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4•7H2O)做处理剂,反应的离子方程式6Fe2+ +
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4•7H2O)做处理剂,反应的离子方程式6Fe2+ + + 14H+ = 6Fe3+ + 2Cr3++ 7H2O
+ 14H+ = 6Fe3+ + 2Cr3++ 7H2O
(2)在该反应中,被氧化的是_______ (填离子符号,下同),还原产物是_______ ,此反应可以推断物质还原性强弱顺序是_______ 。
Ⅲ.高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:3ClO- +2Fe3+ + 10OH- = 2 +_______+ 5H2O
+_______+ 5H2O
(3)请完成该化学方程式并配平_______ 。
(4)该反应中生成2个 转移的电子数为
转移的电子数为_______ 。
Ⅰ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。回答下列问题:
(1)该反应中,氧化剂是
Ⅱ.工业废水中含有的重铬酸根离子(
 )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4•7H2O)做处理剂,反应的离子方程式6Fe2+ +
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4•7H2O)做处理剂,反应的离子方程式6Fe2+ + + 14H+ = 6Fe3+ + 2Cr3++ 7H2O
+ 14H+ = 6Fe3+ + 2Cr3++ 7H2O(2)在该反应中,被氧化的是
Ⅲ.高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:3ClO- +2Fe3+ + 10OH- = 2
 +_______+ 5H2O
+_______+ 5H2O(3)请完成该化学方程式并配平
(4)该反应中生成2个
 转移的电子数为
转移的电子数为
您最近一年使用:0次
2022高三·全国·专题练习
真题
名校
6 . 下列说法错误的是
| A.CaF2与浓H2SO4糊状混合物可用于刻蚀玻璃 |
| B.NaOH是强碱,因此钠盐的水溶液不会呈酸性 |
| C.溶洞的形成主要源于溶解CO2的水对岩石的溶蚀作用 |
| D.KMnO4与H2C2O4的反应中,Mn2+既是还原产物又是催化剂 |
您最近一年使用:0次
2022-10-17更新
|
4639次组卷
|
7卷引用:宁夏回族自治区石嘴山市平罗中学2023-2024学年高三上学期第四次月考理科综合试题
宁夏回族自治区石嘴山市平罗中学2023-2024学年高三上学期第四次月考理科综合试题(已下线)专题04 氧化还原反应-2022年高考真题模拟题分项汇编2022年河北省高考真题化学试题(已下线)2022年河北省高考真题变式题(1-9)(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)辽宁省大连市长海县高级中学2022-2023学年高三上学期期中考试化学试题广东省中山大学附属中学2023-2024学年高三上学期8月阶段性检测化学试题
7 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)制备 需要在
需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化 水,至少需要
水,至少需要 的质量为
的质量为_______ kg。
(5)高铁酸钠 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取:
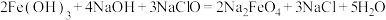
①该反应中氧化剂是_____ (用化学式表示,下同),____ 元素被氧化,还原产物为____ 。
②用双线桥法在方程式中标出电子转移的情况:_____ 。
(6)将 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目____ 。
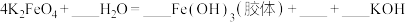
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气  通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mg  ,即可达到卫生标准 ,即可达到卫生标准…… |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化
 水,至少需要
水,至少需要 的质量为
的质量为(5)高铁酸钠
 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: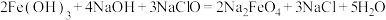
①该反应中氧化剂是
②用双线桥法在方程式中标出电子转移的情况:
(6)将
 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目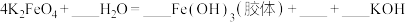
您最近一年使用:0次
名校
8 . 硫化钠俗称臭碱,是重要的化工原料,工业上可用氢氧化钠吸收硫化氢气体制备。
(1)已知:
若用硫化钠固体和下列溶液制取硫化氢气体,可选用的试剂为_______ 。
a.硝酸 b.碳酸氢钠 c.硼酸 d.醋酸
将少量CO2通入Na2S溶液中,写出发生反应的离子方程式_______ 。
(2)某小组同学为检验Na2S变质的产物中是否含有Na2S2O3,设计实验:取久置潮解的Na2S固体溶于水,静置,取少量上层清液于试管中,向其中滴加AgNO3溶液,产生黑色沉淀。由此得出结论:Na2S变质的产物中含Na2S2O3。该实验是否合理_______ (填“是”或“否”),请分析原因_______ 。(已知:白色的Ag2S2O3难溶于水,且易转化为黑色Ag2S)
(3)设计实验证明Na2S的还原性比FeCl2的还原性强:_______ (写出必要的实验操作、现象和结论)。
(1)已知:
| H2S | H3BO3 | H2CO3 | CH3COOH |
| Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=5.8×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka=1.75×10-5 |
若用硫化钠固体和下列溶液制取硫化氢气体,可选用的试剂为
a.硝酸 b.碳酸氢钠 c.硼酸 d.醋酸
将少量CO2通入Na2S溶液中,写出发生反应的离子方程式
(2)某小组同学为检验Na2S变质的产物中是否含有Na2S2O3,设计实验:取久置潮解的Na2S固体溶于水,静置,取少量上层清液于试管中,向其中滴加AgNO3溶液,产生黑色沉淀。由此得出结论:Na2S变质的产物中含Na2S2O3。该实验是否合理
(3)设计实验证明Na2S的还原性比FeCl2的还原性强:
您最近一年使用:0次
名校
解题方法
9 . 物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、F2。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
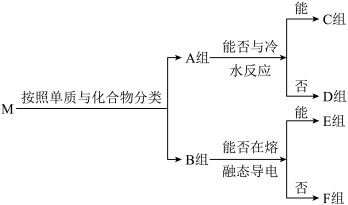
(1)B组物质中属于非电解质的物质为____ ,其中能作制冷剂的物质的电子式为____ 。
(2)C组物质中能与水反应生成还原性气体的化学方程式为____ 。
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:____ 。
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:____ 。
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为____ ;反应中氧化剂与还原剂的物质的量之比为____ 。

(1)B组物质中属于非电解质的物质为
(2)C组物质中能与水反应生成还原性气体的化学方程式为
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为
您最近一年使用:0次
2022-09-23更新
|
601次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
名校
解题方法
10 . 为了实现“碳中和”目标,某研究小组通过钌化合物可催化CO2转化为甲酸,其反应机理如图所示。下列说法错误的是


| A.物质III中Ru的化合价为+2价 |
B..总反应方程式为H2+CO2 HCOOH HCOOH |
| C.催化反应过程中,当1mol物质I转化为物质II时,物质I得到4mol电子 |
| D.整个过程中,有极性键的断裂与形成 |
您最近一年使用:0次
2022-09-23更新
|
1022次组卷
|
4卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题



