1 . 某化合物X有三种元素组成,某学习小组进行了如下实验:___________
(2)混合气体N通入足量的NaOH溶液中,恰好完全反应生成一种盐,其离子反应方程式为______________ 。
(3)黑色固体Y与NH3的化学方程式为____________
(4)若以X ▪ 3H2O进行实验,在170℃时可以生成一种中间产物W。 0.1mol化合物W能与0.6molHCl刚好完全反应,若0.1mol化合物W再继续加热生成黑色固体Y的质量为32.0g。则化合物W的化学式为______________ 。
(5)混合气体N有毒,为保护环境,可以用保险粉(Na2S2O4)吸收。请说明混合气体N能用保险粉吸收的理由___________ 。
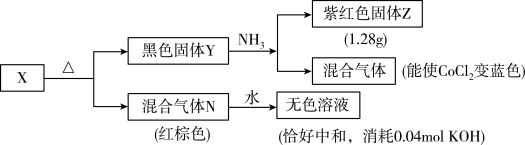
(2)混合气体N通入足量的NaOH溶液中,恰好完全反应生成一种盐,其离子反应方程式为
(3)黑色固体Y与NH3的化学方程式为
(4)若以X ▪ 3H2O进行实验,在170℃时可以生成一种中间产物W。 0.1mol化合物W能与0.6molHCl刚好完全反应,若0.1mol化合物W再继续加热生成黑色固体Y的质量为32.0g。则化合物W的化学式为
(5)混合气体N有毒,为保护环境,可以用保险粉(Na2S2O4)吸收。请说明混合气体N能用保险粉吸收的理由
您最近一年使用:0次
2020-05-02更新
|
305次组卷
|
4卷引用:湖南省永州市祁阳县2021-2022学年高三下学期一模联考化学试题
湖南省永州市祁阳县2021-2022学年高三下学期一模联考化学试题浙江省绍兴市柯桥区2020届高三上学期1月模拟普通高校招生考试化学试题江苏南京鼓楼区2021-2022学年高三下学期模拟考试化学试题(已下线)江苏省南京市玄武高级中学2024届高三下学期二轮模拟化学试题
名校
解题方法
2 . 利用铝热反应原理可以制取金属锰,化学方程式为3MnO2+4Al 3Mn+2Al2O3,该反应的氧化剂是( )
3Mn+2Al2O3,该反应的氧化剂是( )
 3Mn+2Al2O3,该反应的氧化剂是( )
3Mn+2Al2O3,该反应的氧化剂是( )| A.MnO2 | B.Al | C.Mn | D.Al2O3 |
您最近一年使用:0次
2020-03-09更新
|
489次组卷
|
10卷引用:湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(学考)
湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(学考)湖南省普通高中2016-2017学年高二学业水平考试模拟化学试题云南省云天化中学2019-2020学年高一9月月考化学试题陕西省吴起高级中学2019-2020学年高一上学期期中考试化学(能力卷)试题湖南省邵东县创新实验学校2019-2020学年高二上学期期中考试化学(文)试题广东省潮州市潮安区龙溪中学2019-2020学年上学期普通高中学业水平测试合格考化学试题2015年湖南省普通高中学业水平考试化学试题湖南省益阳市箴言中学2019-2020学年高二上学期期末学业水平考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第三次月考化学试题湖南省2020-2021学年普通高中学业水平合格性考试模拟化学试题
3 . 今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度,其工艺流程如图所示:

(1)Ge在元素周期表中的位置是________________ 。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是_______________________ 。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式__________ 。酸浸时温度不能过高的原因是______________________________________ 。
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为______________ 。温度对GeCl4水解率的影响如下图所示,为提高水解率,实验时可采取的措施为______ (填序号)。
A.冰水浴 B.冰盐水浴 C.49℃水浴

(5)GeO2是锗酸(H2GeO3)的酸酐。请通过计算判断25℃时0.1mol·L-1的 NaHGeO3溶液pH_________ (填“>”=”或“<”)7,理由是_____________________________ 。(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka,2=1.9×10-13)。

(1)Ge在元素周期表中的位置是
(2)800℃,在N2氛围中使精硫锗矿升华的目的是
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为
A.冰水浴 B.冰盐水浴 C.49℃水浴

(5)GeO2是锗酸(H2GeO3)的酸酐。请通过计算判断25℃时0.1mol·L-1的 NaHGeO3溶液pH
您最近一年使用:0次
4 . 从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:

(1)操作②的名称为_______________ ,操作①的目的是___________________________ 。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________ 。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________ 。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______ 。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________ 。

(1)操作②的名称为
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
| 物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为
您最近一年使用:0次
解题方法
5 . 工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:

(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________ (填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________ 。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________ 。

(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________ 。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________ 。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________ 。

(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是

(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是
您最近一年使用:0次
2018-12-22更新
|
167次组卷
|
2卷引用:湖南省永州市双牌县第二中学2019届高三上学期12月月考化学试题
6 . 碲是ⅥA 族元素,其单质和化合物在化工生产等方面具有广泛地应用。
(1)TeO2 是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2 和足量 NaOH 溶液发生反应的离子方程式为_____ 。
(2)从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲的一种工艺流程如图:
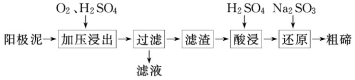
①已知加压酸浸时控制溶液的 pH 为 5.0,生成 TeO2 沉淀。如果 H2SO4 溶液浓度过大,产生 的后果是______________________________________________ 。
②对滤渣“酸浸”后,将 Na2SO3 加入 Te(SO4)2 溶液中进行“还原”得到固态碲,该反应的离子 方程式是______________________________________________ 。
③“还原”得到固态碲后分离出粗碲后,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____ 。
(3)已知阳极泥中 Cu2Te 的含量为 a%,则 m 吨阳极泥理论上可制得纯度为 n%的粗碲_____ 吨。
(1)TeO2 是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2 和足量 NaOH 溶液发生反应的离子方程式为
(2)从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲的一种工艺流程如图:

①已知加压酸浸时控制溶液的 pH 为 5.0,生成 TeO2 沉淀。如果 H2SO4 溶液浓度过大,产生 的后果是
②对滤渣“酸浸”后,将 Na2SO3 加入 Te(SO4)2 溶液中进行“还原”得到固态碲,该反应的离子 方程式是
③“还原”得到固态碲后分离出粗碲后,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是
(3)已知阳极泥中 Cu2Te 的含量为 a%,则 m 吨阳极泥理论上可制得纯度为 n%的粗碲
您最近一年使用:0次
名校
解题方法
7 . 金属及其化合物在生产中用途广泛。
I.利用生产硼砂的废渣一硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO2、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:

(1)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式________________________ 。
(2)滤渣2的主要成分有MnO2和________ ,写出生成MnO2的离子方程式_____________ 。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是______________ 。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_________________ 。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为____________________ 。
(6)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_______ 。
I.利用生产硼砂的废渣一硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO2、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:

(1)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式
(2)滤渣2的主要成分有MnO2和
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(6)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为
您最近一年使用:0次
名校
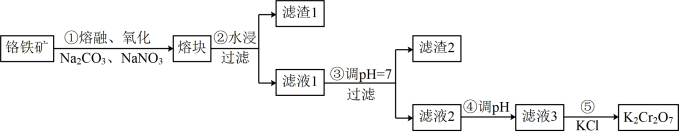
8 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________ 。该步骤不能使用陶瓷容器,原因是_________ 。
(2)滤渣1中含量最多的金属元素是_______ ,滤渣2的主要成分是__________ 及含硅杂质。
(3)步骤④调滤液2的pH使之变______ (填“大”或“小”),原因是___________________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
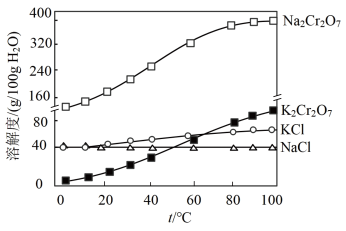
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是
您最近一年使用:0次
2017-10-28更新
|
405次组卷
|
4卷引用:湖南省永州市祁阳县高考补习学校2018届高三上学期第二次月考化学试题
湖南省永州市祁阳县高考补习学校2018届高三上学期第二次月考化学试题(已下线)【优等生百日捷进提升系列】专题09 工艺流程题江西省南昌市第二中学2019-2020学年高二下学期期末考试化学试题河南省焦作第一中学2023-2024学年高三上学期10月模拟化学测试
解题方法
9 . 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。

(1)写出单质B与强碱溶液反应的离子方程式___________________________ ,写出由沉淀J生成H溶液的离子方程式_______________________________ 。
(2)溶液E中加入氨水时,先生成白色沉淀L,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式______________________________ 。
(3) K是一种集消毒与净水为一体的新型净水剂,试写出G→K的化学方程式:_______________
(4)溶液I中所含金属离子是__________________ 。

(1)写出单质B与强碱溶液反应的离子方程式
(2)溶液E中加入氨水时,先生成白色沉淀L,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式
(3) K是一种集消毒与净水为一体的新型净水剂,试写出G→K的化学方程式:
(4)溶液I中所含金属离子是
您最近一年使用:0次
名校
解题方法
10 . 硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________ ;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
__ S2O +
+__ Mn2++__ =___ MnO4-+__ SO +
+____ 。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________ 。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
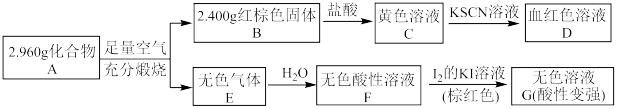
①A的化学式为____________ ;
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:_______________________ 。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
 +
+ +
+(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:

①A的化学式为
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:
您最近一年使用:0次
2017-10-13更新
|
292次组卷
|
4卷引用:湖南省永州市祁阳县第一中学2018届高三10月月考化学试题



