1 . 有机物M(如图所示)是合成某新型绿色农药的中间体,下列说法正确的是
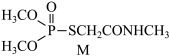
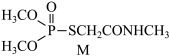
A.中子数为8的碳原子: | B.电负性: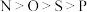 |
C.碳原子的杂化方式为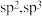 | D.简单离子半径: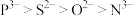 |
您最近半年使用:0次
2023-04-24更新
|
117次组卷
|
3卷引用:河南省新乡市2022-2023学年高二下学期4月期中考试化学试题
解题方法
2 . 我国科学家发现AgCrS2 (AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有___________ 个电子顺时针旋转。基态铬原子有___________ 个未成对电子。
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是___________ (填元素符号)。
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。 的空间构型为
的空间构型为___________ ,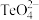 中碲的杂化类型是
中碲的杂化类型是___________ 。
③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(3)配合物 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为___________ 。(Cr与O、N均形成了配位键)
(4)在银氨溶液中,1 mol 中含
中含___________ molσ键。
(5)复合材料氧铬酸钙的立方晶胞如图所示。
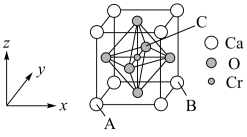
①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为___________ 。
②1个钙原子与___________ 个氧原子等距离且最近。
③该晶体密度为___________  (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。
 的空间构型为
的空间构型为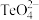 中碲的杂化类型是
中碲的杂化类型是③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(3)配合物
 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为(4)在银氨溶液中,1 mol
 中含
中含(5)复合材料氧铬酸钙的立方晶胞如图所示。

①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为
②1个钙原子与
③该晶体密度为
 (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
您最近半年使用:0次
2021-12-03更新
|
556次组卷
|
3卷引用:河南省新乡市2021-2022学年高三上学期第一次模拟考试理综化学试题
河南省新乡市2021-2022学年高三上学期第一次模拟考试理综化学试题 河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
解题方法
3 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)基态B原子的电子排布式为_______ ;B和N相比,电负性较大的是_______ ,BN中B元素的化合价为_______ ;
(2)在BF3分子中,F-B-F的键角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF4,BF 的立体结构为
的立体结构为_______ ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_______ ,层间作用力为_______ ;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______ g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。

请回答下列问题:
(1)基态B原子的电子排布式为
(2)在BF3分子中,F-B-F的键角是
 的立体结构为
的立体结构为(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是
您最近半年使用:0次
名校
4 . C、N、O、Al、Si、Cu是常见的六种元素,下列说法错误的是
| A.Si位于元素周期表第三周期第 ⅣA 族 |
| B.O、Na、P、Cl四种元素中电负性最大的是Cl, 其中P原子的核外电子排布式为 1s22s22p63s23p3 |
| C.基态锗(Ge)原子的电子排布式是1s22s22p63s23p63d104s24p2 ,Ge的最高价氯化物的分子式是GeCl4 |
| D.Ge的最高价氯化物的沸点低于其溴化物的沸点 |
您最近半年使用:0次
2021-09-29更新
|
185次组卷
|
2卷引用:河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题
名校
解题方法
5 . (1)溴苯和硅在催化剂铜的存在下加热,可以生成C6H5SiBr3和H5C6-C6H5,基态铜原子的价电子排布式为___________ ,形成硅化物中硅的杂化类型为___________ 。已知硅的氢化物SiH4中Si显正电性,在上述反应中所有非金属元素的电负性由大到小的顺序为___________ 。
(2)硅是亲氧元素,在自然界以氧化物和含氧酸盐形式存在,硅和碳同主族但SiO2比CO2熔点高的原因是___________ ,SiO 的空间构型为
的空间构型为___________ 。
(3)硅在不同条件下的晶体结构不同
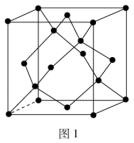
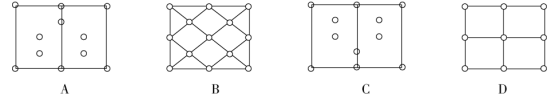
①常温时为金刚石型结构如图1,该结构中硅原子与Si-Si键的数量比为___________ ,下图中为晶胞(图1)对角面的投影图(以表示硅原子)的是___________ 。(填选项)
②当条件变为12 Gpa时,硅晶体为四方晶系,晶胞如图2,晶胞参数a=183 pm,c=900pm,晶胞的密度为___________ g/cm3(阿伏加德罗常数的值为6.02×1023写出计算式)

(2)硅是亲氧元素,在自然界以氧化物和含氧酸盐形式存在,硅和碳同主族但SiO2比CO2熔点高的原因是
 的空间构型为
的空间构型为(3)硅在不同条件下的晶体结构不同

①常温时为金刚石型结构如图1,该结构中硅原子与Si-Si键的数量比为

②当条件变为12 Gpa时,硅晶体为四方晶系,晶胞如图2,晶胞参数a=183 pm,c=900pm,晶胞的密度为

您最近半年使用:0次
名校
解题方法
6 . 银离子导体是发现最早的固体电解质,同时也是应用面最广的固体电解质,如制作库仑计、电子开关、压敏元件、气敏传感器、记忆元件、电容器等电化学器件。
回答以下问题:
(1)Ag+的价层电子排布式为4d10,写出Ag在周期表中的位置___ 。
(2)第三周期各元素的氯化物熔点、沸点数据如下:
请解释第三周期氯化物沸点从左到右变化的原因:___ 。
(3)偏高碘酸HIO4是无机非混合酸中氧化性极强的酸之一,可将Mn氧化为HMnO4,将Fe2+氧化为H2FeO4。HIO4的中心原子杂化形式是__ ,构成HIO4的三种元素电负性大小顺序是___ ,在HIO4晶体中存在___ (填字母)
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力 E.σ键 F.π键
(4)室温下,AgI属于六方ZnS结构,其中S原子作六方密堆积,Zn原子填充在半数的四面体空隙中。则AgI晶体中I原子的配位数是___ 。
(5)400℃以上AgI固体的导电能力是室温的上万倍,可与电解质溶液媲美,经研究发现其在146℃以上转化为一种奇特结构:α—AgI,I-作体心立方堆积,而Ag+则选择性填入I-构成的三类孔隙中:八面体孔隙(O)、四面体孔隙(T)和三角形孔隙(Tr),则平均每个α—AgI晶胞中的Ag+数是___ ,I-与I-构成的三类孔隙堆积之比为I-:O:T:Tr=1:__ :__ :12。

回答以下问题:
(1)Ag+的价层电子排布式为4d10,写出Ag在周期表中的位置
(2)第三周期各元素的氯化物熔点、沸点数据如下:
| NaCl | MgCl2 | AlCl3 | SiCl4 | PCl3 | S2Cl2 | |
| 熔点/K | 1074 | 987 | 465 | 205 | 181 | 193 |
| 沸点/K | 1686 | 1691 | 453(升华) | 216 | 349 | 411 |
请解释第三周期氯化物沸点从左到右变化的原因:
(3)偏高碘酸HIO4是无机非混合酸中氧化性极强的酸之一,可将Mn氧化为HMnO4,将Fe2+氧化为H2FeO4。HIO4的中心原子杂化形式是
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力 E.σ键 F.π键
(4)室温下,AgI属于六方ZnS结构,其中S原子作六方密堆积,Zn原子填充在半数的四面体空隙中。则AgI晶体中I原子的配位数是
(5)400℃以上AgI固体的导电能力是室温的上万倍,可与电解质溶液媲美,经研究发现其在146℃以上转化为一种奇特结构:α—AgI,I-作体心立方堆积,而Ag+则选择性填入I-构成的三类孔隙中:八面体孔隙(O)、四面体孔隙(T)和三角形孔隙(Tr),则平均每个α—AgI晶胞中的Ag+数是

您最近半年使用:0次
2021-05-18更新
|
639次组卷
|
3卷引用:河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题
名校
解题方法
7 . 对Na、Mg、Al的有关性质的叙述正确的是:
| A.碱性:NaOH< Mg(OH)2< Al(OH)3 | B.第一电离能:Na< Mg <Al |
| C.还原性:Na> Mg >Al | D.电负性:Na> Mg >Al |
您最近半年使用:0次
2020-11-12更新
|
565次组卷
|
63卷引用:河南省宏力学校2018-2019学年高二下学期期中考试化学试题
河南省宏力学校2018-2019学年高二下学期期中考试化学试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016学年吉林梅河口五中高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题福建省福州三中2017-2018学年高二上学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题
8 . 根据有关知识,回答下列问题。
(1)化学元素(0族和放射性元素除外)中,第一电离能最小的元素是___ (填元素符号,下同),第一电离能最大的元素是___ ,电负性最大的元素是___ 。
(2)铜的原子序数是29,其价电子排布式为___ 。
(3)元素的电负性越大,则在形成化合物时此元素___ 越强。
(4)Be的第一电离能大于B的第一电离能,这是因为___ 。
(1)化学元素(0族和放射性元素除外)中,第一电离能最小的元素是
(2)铜的原子序数是29,其价电子排布式为
(3)元素的电负性越大,则在形成化合物时此元素
(4)Be的第一电离能大于B的第一电离能,这是因为
您最近半年使用:0次
2020-04-09更新
|
608次组卷
|
4卷引用:河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题
河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题江苏省盘湾中学、陈洋中学2017-2018学年高二上学期期中联考(选修)化学试题第1章 原子结构 易错疑难集训(二)——A学习区 夯实基础(鲁科版选修3)(已下线)第一单元 原子结构(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
9 . 我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____ 。
(2)氯离子的基态电子排布式为_____ ,有_____ 种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____ (用元素符号表示)。
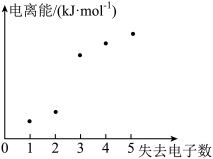
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____ (填元素符号)元素同周期。
(1)基态氮原子价层电子的轨道表示式为
(2)氯离子的基态电子排布式为
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的

您最近半年使用:0次
2020-03-27更新
|
714次组卷
|
3卷引用:河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题
河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题山东省泰安市2019-2020学年高二上学期期末考试化学试题(已下线)易错25 电离能和电负性-备战2021年高考化学一轮复习易错题



