名校
1 . 用下列实验装置进行相应实验,不能达到实验目的的是
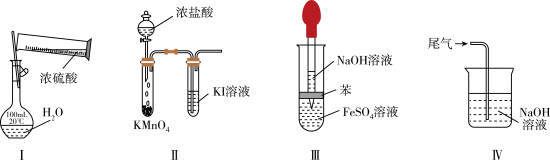

| A.实验Ⅰ:配制 100 mL 0.100 mol·L1稀硫酸 |
| B.实验Ⅱ:比较 KMnO4、Cl2、I2的氧化性强弱 |
| C.实验 III:制取并观察 Fe(OH)2沉淀 |
| D.实验Ⅳ:NO2尾气处理 |
您最近一年使用:0次
2020-10-18更新
|
184次组卷
|
2卷引用:江苏省淮安市涟水县第一中学2021届高三上学期10月月考化学试题
2 . 已知2Mg+CO2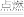 2MgO+C,某同学认为钠与二氧化碳也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与二氧化碳的反应进行了实验探究。依据要求回答问题:
2MgO+C,某同学认为钠与二氧化碳也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与二氧化碳的反应进行了实验探究。依据要求回答问题:

(1)实验室制备二氧化碳的化学方程式为____________________________________ 。
(2)为达到实验目的,选择图中的装置,其连接顺序为c→______________ (填气流方向,用小写字母表示)。
(3)检查装置气密性良好,装好药品后打开弹簧夹,待装置中的空气排尽后才能点燃酒精灯。能说明装置中空气已经排尽的现象是______________________________ 。
(4)该同学用稀盐酸与CaCO3反应制备CO2,向装置B中加入稀盐酸后,发现CaCO3与稀盐酸没有接触。由于盐酸已经用完,为使反应顺利进行可再加入的试剂是________ (填字母)(注:苯的密度比水的小,CCl4的密度比水的大)。
A.稀硝酸 B.H2SO4溶液
C.苯 D.CCl4
(5)该同学经过反思,认为上述实验中存在缺陷。该缺陷是____________________ 。
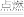 2MgO+C,某同学认为钠与二氧化碳也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与二氧化碳的反应进行了实验探究。依据要求回答问题:
2MgO+C,某同学认为钠与二氧化碳也可以发生类似的反应,他在实验室中选择如图所示的装置对钠与二氧化碳的反应进行了实验探究。依据要求回答问题:
(1)实验室制备二氧化碳的化学方程式为
(2)为达到实验目的,选择图中的装置,其连接顺序为c→
(3)检查装置气密性良好,装好药品后打开弹簧夹,待装置中的空气排尽后才能点燃酒精灯。能说明装置中空气已经排尽的现象是
(4)该同学用稀盐酸与CaCO3反应制备CO2,向装置B中加入稀盐酸后,发现CaCO3与稀盐酸没有接触。由于盐酸已经用完,为使反应顺利进行可再加入的试剂是
A.稀硝酸 B.H2SO4溶液
C.苯 D.CCl4
(5)该同学经过反思,认为上述实验中存在缺陷。该缺陷是
您最近一年使用:0次
名校
3 . AlCl3易升华、易潮解,某实验小组欲用下图所示装置制备并收集AlCl3,对实验过程中预见的若干问题小组成员列出如下解决策略,其中不能解决问题的是


| 问题 | 解决策略 | |
| A | 装置I中浓盐酸可能滴不下来 | 将分液漏斗换成恒压滴液漏斗 |
| B | 铝粉或AlCl3固体可能堵塞导管 | 在装置IV 的右侧导管口加棉花或玻璃纤维 |
| C | 装置内局部压强过大 | 在装置II中加一插入液面下的长颈漏斗 |
| D | AlCl3蒸气冷凝不充分 | 装置V添加冰水浴 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 某工厂的废水中只含硫酸镁和少量硫酸,为从中回收纯净的硫酸镁固体,某课外活动小组设计了两种不同的方案,请你参与讨论。
(1)方案一,选用镁粉为试剂。
①往废水中逐渐加入镁粉,当观察到______________________________ 时,说明加入的镁粉已经过量。此过程中发生反应的化学方程式是______________________________ 。
②接下来的操作依次是__________ 和__________ 。
(2)方案二,选用氢氧化钠溶液为试剂。
①向废水中逐滴加入氢氧化钠溶液,当______________________________ 时,停止滴加。此过程中发生反应的化学方程式为________________________________________ 。
②为了得到纯净的硫酸镁溶液,接着应进行的实验操作是(简要写出操作过程)_______________ 。
③……得到硫酸镁固体。
(3)比较两个方案,假设实验中都没有损耗,那么,最后得到的硫酸镁固体的质量是否相同?___________ (填“相同”或“不相同”),原因是____________________ 。
(4)请你继续研究,设计一个新的方案(使用的试剂必须与铁和氢氧化钠属于不同类别),你选用的试剂是____________________ (填化学式),该过程中发生反应的化学方程式为___________________ 。
(5)试从生产经济成本,实际操作等方面对题给两种方案进行简单的评价_________________________________________________________________ 。
(1)方案一,选用镁粉为试剂。
①往废水中逐渐加入镁粉,当观察到
②接下来的操作依次是
(2)方案二,选用氢氧化钠溶液为试剂。
①向废水中逐滴加入氢氧化钠溶液,当
②为了得到纯净的硫酸镁溶液,接着应进行的实验操作是(简要写出操作过程)
③……得到硫酸镁固体。
(3)比较两个方案,假设实验中都没有损耗,那么,最后得到的硫酸镁固体的质量是否相同?
(4)请你继续研究,设计一个新的方案(使用的试剂必须与铁和氢氧化钠属于不同类别),你选用的试剂是
(5)试从生产经济成本,实际操作等方面对题给两种方案进行简单的评价
您最近一年使用:0次
5 . 下列实验方案中。能达到实验目的的是( )
A.用KMnO4标准溶液进行滴定 |
B.除去Cl2中少量的HCl  |
C.比较HCl、H2CO3和H2SiO3的酸性强弱 |
D.验证2NO2(g) N2O4(g)为放热反应 N2O4(g)为放热反应 |
您最近一年使用:0次
解题方法
6 . 某同学清洗银镜实验后试管内壁上的银并探究其中的反应原理,进行下列实验。
(1)用稀硝酸可以清洗试管内壁上的银,反应的化学方程式为____________________________ 。
(2)为消除(1)中所产生的污染问题,改为如下实验。
①该同学由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能性。他的操作及现象是:取实验I所得液体于试管中,_________________________________ 。
②经查阅资料,发现:实验I中银镜溶解后经一系列反应,最后产物为Ag,但是因为颗粒很小(直径在1~100 nm间)分散在液体中,肉眼无法识别。该同学设计实验,证实了a中存在直径在1~100 nm间的颗粒。他的操作及现象是:_____________________________________ 。
③写出实验I的化学方程式:_________________________________________________ 。
(3)进一步探究银的化合物在H2O2分解反应中的作用,进行如下实验。
①实验II的目的是___________________________________________________ 。
根据实验Ⅲ的现象提出假设:
假设1:Ag2O在H2O2分解反应中作氧化剂;假设2:Ag2O在H2O2分解反应中作催化剂。
②若假设1成立,请写出该反应的化学方程式:________________________________ 。
③结合所给试剂,请设计一个简单的实验证明假设1,并将表格填写完整。
可选试剂:1 mol·L-1盐酸、0.1 mol·L-1氨水、1 mol·L-1 NaOH溶液
(1)用稀硝酸可以清洗试管内壁上的银,反应的化学方程式为
(2)为消除(1)中所产生的污染问题,改为如下实验。
| 实验编号 | 操 作 | 现 象 |
I | 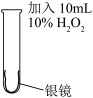 | 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a。 |
②经查阅资料,发现:实验I中银镜溶解后经一系列反应,最后产物为Ag,但是因为颗粒很小(直径在1~100 nm间)分散在液体中,肉眼无法识别。该同学设计实验,证实了a中存在直径在1~100 nm间的颗粒。他的操作及现象是:
③写出实验I的化学方程式:
(3)进一步探究银的化合物在H2O2分解反应中的作用,进行如下实验。
| 实验编号 | 操 作 | 现 象 |
II | 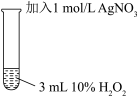 | 振荡,溶液无明显现象。 |
III |  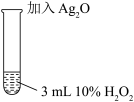 | 剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体。 |
根据实验Ⅲ的现象提出假设:
假设1:Ag2O在H2O2分解反应中作氧化剂;假设2:Ag2O在H2O2分解反应中作催化剂。
②若假设1成立,请写出该反应的化学方程式:
③结合所给试剂,请设计一个简单的实验证明假设1,并将表格填写完整。
可选试剂:1 mol·L-1盐酸、0.1 mol·L-1氨水、1 mol·L-1 NaOH溶液
| 实验步骤和操作 | 实验现象及结论 |
| 取3 mL 10% H2O2在试管中,加入少量Ag2O,充分反应后, |
您最近一年使用:0次
解题方法
7 .  溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
(1)该反应的离子方程式为_____________ 。
(2)该实验的目的是探究___________ 对反应速率的影响。
(3)实验试剂除了 溶液、
溶液、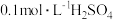 溶液外,还需要的指示剂是
溶液外,还需要的指示剂是________ 。实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是___________ 。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________ (填字母)。
A.温度 B.指示剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
(5)由上述实验记录可得出的结论是温度每升高 ,反应速率增大为原来的
,反应速率增大为原来的____ 倍。
(6)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是_______ 。
 溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(2)该实验的目的是探究
(3)实验试剂除了
 溶液、
溶液、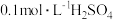 溶液外,还需要的指示剂是
溶液外,还需要的指示剂是(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是
A.温度 B.指示剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
(5)由上述实验记录可得出的结论是温度每升高
 ,反应速率增大为原来的
,反应速率增大为原来的(6)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是
您最近一年使用:0次
8 . 某学生在做同一主族元素性质的递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管。
药品:新制的氯水、新制的溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在表中横线处填写相关内容):
(4)实验结论:___________ 。
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为___________ 、__________ 。
②请用本章所学内容简单说明得出上述结论的原因_____________ 。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管。
药品:新制的氯水、新制的溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在表中横线处填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制的溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
(4)实验结论:
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为
②请用本章所学内容简单说明得出上述结论的原因
您最近一年使用:0次
9 . 一定温度下,某同学欲探究浓度对化学平衡的影响,设计实验如下:
Ⅰ.向 溶液中加入
溶液中加入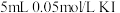 溶液,反应达到平衡后分成两等份。
溶液,反应达到平衡后分成两等份。
Ⅱ.向其中一份中加入 溶液,溶液变红,再向其中加入
溶液,溶液变红,再向其中加入 ,振荡,静置,下层显极浅的紫色。
,振荡,静置,下层显极浅的紫色。
Ⅲ.向另外一份中加入 ,振荡,静置,下层显紫色。
,振荡,静置,下层显紫色。
下列说法错误的是( )
Ⅰ.向
 溶液中加入
溶液中加入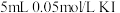 溶液,反应达到平衡后分成两等份。
溶液,反应达到平衡后分成两等份。Ⅱ.向其中一份中加入
 溶液,溶液变红,再向其中加入
溶液,溶液变红,再向其中加入 ,振荡,静置,下层显极浅的紫色。
,振荡,静置,下层显极浅的紫色。Ⅲ.向另外一份中加入
 ,振荡,静置,下层显紫色。
,振荡,静置,下层显紫色。下列说法错误的是( )
A.实验Ⅰ中发生的反应为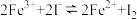 |
B.水溶液中的 :Ⅱ>Ⅲ :Ⅱ>Ⅲ |
C.水溶液中的 :Ⅰ<Ⅱ :Ⅰ<Ⅱ |
D.若在实验Ⅰ中加入少量 固体, 固体,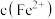 会增大 会增大 |
您最近一年使用:0次
2020-09-20更新
|
218次组卷
|
2卷引用:鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度
名校
10 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,白色晶体,可溶于水,微溶于乙醇;暴露在空气中易被氧化成亚硫酸氢钠或硫酸氢钠,75℃以上会分解。
(1)Na2S2O4的制取(实验装置如图):
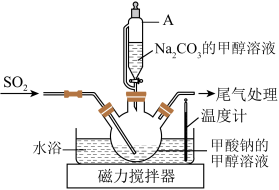
在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3的甲醇溶液,同时通SO2,反应放热,保持温度为60~70℃,即可生成Na2S2O4,同时生成另一种气体。
①仪器A的名称是__________ ,与普通分液漏斗相比,其优点是__________ 。
②三颈烧瓶中生成Na2S2O4的离子方程式为____________ 。
③为了使反应充分进行,得到更多更纯的产品Na2S2O4,应采取的主要措施有_______ 。
A.控制水浴温度不超过75℃
B.加快通SO2的速率
C.加快滴加Na2CO3的甲醇溶液的速率
D.充分搅拌,使反应物充分接触
E.用乙醇洗涤产品,减少因溶解导致的损失
F.在通入SO2前还应该通入一段时间N2,以排尽装置内的空气
(2)Na2S2O4的性质:
取纯净的Na2S2O4晶体,隔绝空气加热,Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和气体产物_____ (填化学式)。请设计实验验证Na2S2O4固体完全分解后的固体产物中有Na2S2O3存在,完成下表中内容。(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤预期现象和结论
(3)Na2S2O4的应用:
六价铬对人体有毒,Na2S2O4可以用于处理含铬废水,使含六价铬的离子浓度降低而达到排放标准,即含六价铬的离子浓度≤0.5mg∙L-1。具体操作是:在含六价铬( )的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有
)的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有_______ (用化学式表示)。
(1)Na2S2O4的制取(实验装置如图):

在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3的甲醇溶液,同时通SO2,反应放热,保持温度为60~70℃,即可生成Na2S2O4,同时生成另一种气体。
①仪器A的名称是
②三颈烧瓶中生成Na2S2O4的离子方程式为
③为了使反应充分进行,得到更多更纯的产品Na2S2O4,应采取的主要措施有
A.控制水浴温度不超过75℃
B.加快通SO2的速率
C.加快滴加Na2CO3的甲醇溶液的速率
D.充分搅拌,使反应物充分接触
E.用乙醇洗涤产品,减少因溶解导致的损失
F.在通入SO2前还应该通入一段时间N2,以排尽装置内的空气
(2)Na2S2O4的性质:
取纯净的Na2S2O4晶体,隔绝空气加热,Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和气体产物
实验步骤预期现象和结论
| 实验步骤 | 预期现象和结论 |
(3)Na2S2O4的应用:
六价铬对人体有毒,Na2S2O4可以用于处理含铬废水,使含六价铬的离子浓度降低而达到排放标准,即含六价铬的离子浓度≤0.5mg∙L-1。具体操作是:在含六价铬(
 )的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有
)的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有
您最近一年使用:0次



