名校
解题方法
1 . 某小组以Ba(OH)2、水、H2SO4、Na2SO4为实验对象探究离子反应发生的条件。
(1) Ba(OH)2与H2SO4在溶液中能发生__________ 反应。
a.置换反应 b.酸碱中和反应 c.复分解反应
(2) ①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了_______________ 。
(3) 用离子方程式 解释过程I中灯泡变暗的原因_______________ 。
(4) 实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是_____ 。
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5) 在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。
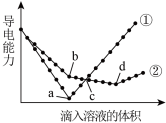
下列分析不正确 的是__________ 。
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-、SO
C. c点,两份溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
| 实验1:向烧杯中 | |
 | ①Ba(OH)2粉末:灯泡不亮 ②加入蒸馏水:灯泡变亮 ③逐滴滴加0.1 mol/L H2SO4,灯泡变化如下: 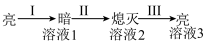 |
a.置换反应 b.酸碱中和反应 c.复分解反应
(2) ①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了
(3) 用
(4) 实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5) 在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-、SO

C. c点,两份溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
您最近一年使用:0次
2020-11-10更新
|
419次组卷
|
5卷引用:北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题
北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题(已下线)专题卷一 离子反应(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)北京市中关村中学2021-2022学年高一上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高一上学期期中考试化学试卷江西省兴国中学2023-2024学年高一下学期第一次月考(开学)化学试题
19-20高一·浙江·阶段练习
解题方法
2 . 现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。

(1)B装置的作用是___ 。
(2)C装置的作用是___ 。
(3)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22g,则x的值为___ 。
(4)该装置还不是很完善,可能使测定结果偏小,应如何改进___ ?。

(1)B装置的作用是
(2)C装置的作用是
(3)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22g,则x的值为
(4)该装置还不是很完善,可能使测定结果偏小,应如何改进
您最近一年使用:0次
19-20高一·浙江·阶段练习
3 . 某同学用某种粗盐进行提纯实验,步骤见下图。

(1)步骤①和②的操作名称是____________ 。
(2)步骤③判断加入盐酸“适量”的方法是____________ 。步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止____________ ,当蒸发皿中有较多量固体出现时,应____________ 用余热使水分蒸干。
(3)猜想和验证:

(1)步骤①和②的操作名称是
(2)步骤③判断加入盐酸“适量”的方法是
(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想I:固体A中含碳酸盐 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 猜想I成立 | |
| 猜想II:固体A中含BaCO3 | 取少量固体A于试管中,先滴入 | 有气泡放出,无白色沉淀生成 | |
| 猜想III:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, | 猜想III成立 |
您最近一年使用:0次
解题方法
4 . 50mL1.0 mol∙L-1盐酸跟50mL1.1 mol∙L-1氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
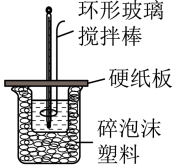
(1)大小烧杯间填满碎泡沫塑料的作用是___ 。
(2)不能将环形玻璃搅拌棒改为环形金属(如铜)棒,其原因是___ 。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是___ (填“偏高”“偏低”或“无影响”)。
(4)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据:
已知盐酸、NaOH溶液密度近似为1.00g·cm-3,中和后混合液的比热容c=4.184×10-3kJ•g-1•c-1则该反应的中和热为ΔH=___ (保留小数点后一位)。
(5)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是___ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度

(1)大小烧杯间填满碎泡沫塑料的作用是
(2)不能将环形玻璃搅拌棒改为环形金属(如铜)棒,其原因是
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是
(4)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t1-t2)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
(5)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
您最近一年使用:0次
名校
5 . 苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:

(1)写出A中主要反应的化学方程式:________ 。
(2)试管C中四氯化碳的作用是_____________ 。
(3)反应开始后,观察试管D和试管E, 看到的现象分别D:____________ ; E:______________ 。
(4)仪器B中的NaOH溶液的作用是_______ ,可观察到的现象是__________ 。
(5)在上述整套装置中,除D装置具有防倒吸作用以外,还有_______ 装置(填字母) 具有防倒吸作用。

(1)写出A中主要反应的化学方程式:
(2)试管C中四氯化碳的作用是
(3)反应开始后,观察试管D和试管E, 看到的现象分别D:
(4)仪器B中的NaOH溶液的作用是
(5)在上述整套装置中,除D装置具有防倒吸作用以外,还有
您最近一年使用:0次
19-20高一下·江西南昌·阶段练习
解题方法
6 . 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是 NO 而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中 K 为止水夹(处于关闭状态),F 是一半空的注射器。请回答有关问题:
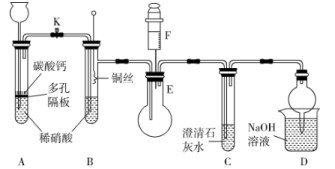
(1)设计装置 A 的目的是______________ 。
(2)在完成(1)中的“操作”后,将装置 B 中铜丝插入稀硝酸并微热,观察到装置 B 中的现象是______ ;发生反应的离子方程式为__________ 。
(3)装置 E 和 F 的作用是________ ;为实现此作用,其操作方法是_________ 。
(4)装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有________ 的功能。

(1)设计装置 A 的目的是
(2)在完成(1)中的“操作”后,将装置 B 中铜丝插入稀硝酸并微热,观察到装置 B 中的现象是
(3)装置 E 和 F 的作用是
(4)装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有
您最近一年使用:0次
名校
解题方法
7 . 某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示,镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验I :用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测I:可能是____________________ 。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
(3)设计定量实验确定实验I的产物,称取实验I中所得干燥、纯净的白色不溶物36.8 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重3.6 g,装置B增重13.2 g,试确定白色不溶物的化学式____________ 。

(4)请结合化学用语和化学平衡移动原理解释 Mg 和饱和 NaHCO3溶液反应产生大量气泡的原因__________________________________________ 。
实验I :用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测I:可能是
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序 号 | 实验 | 预期现象和结论 |
| 实验II | 将实验I中收集的气体点燃 | |
| 实验III | 取实验I中的白色不溶物,洗涤,加入足量 | 如果出现 |
| 实验IV | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在 |

(4)请结合化学用语和化学平衡移动原理解释 Mg 和饱和 NaHCO3溶液反应产生大量气泡的原因
您最近一年使用:0次
2020-10-24更新
|
219次组卷
|
2卷引用:辽宁省沈阳辽宁省实验中学2021届高三上学期月考化学试题
名校
8 . 德国化学家凯库勒认为,苯分子的结构中碳碳间以单、双键文替排列结合成环状。为了验证凯库勒的观点,并制备一定量纯净的溴苯,某学生设计了以下实验方案:

①按如图所示的装置连接好仪器;
②……
③在A中加入适量的苯和液溴,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中气体收集满后,将导管b的下端插入烧杯里的水中,挤压预先盛有水的胶头滴管,观察实验现象。
(1)②中的实验操作应为_________ 。
(2)装置B中盛放的试剂为四氯化碳,其作用是_________ 。
(3)能证明凯库勒观点错误的实验现象是________ 。
(4)反应后,将A中混合液先加入10 mL水,过滤除去铁屑;再依次用水和氢氧化钠洗涤产品,向分出的粗溴苯中加入少量的无水氯化钙,目的是________ 。
(5)经以上分离操作后,澳苯中可能还有未反应完的原料,为了进一步提纯,下列操作中必须的是____ (填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取

①按如图所示的装置连接好仪器;
②……
③在A中加入适量的苯和液溴,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中气体收集满后,将导管b的下端插入烧杯里的水中,挤压预先盛有水的胶头滴管,观察实验现象。
(1)②中的实验操作应为
(2)装置B中盛放的试剂为四氯化碳,其作用是
(3)能证明凯库勒观点错误的实验现象是
(4)反应后,将A中混合液先加入10 mL水,过滤除去铁屑;再依次用水和氢氧化钠洗涤产品,向分出的粗溴苯中加入少量的无水氯化钙,目的是
(5)经以上分离操作后,澳苯中可能还有未反应完的原料,为了进一步提纯,下列操作中必须的是
A.重结晶 B.过滤 C.蒸馏 D.萃取
您最近一年使用:0次
9 . 某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀。
①实验i中的现象是________ 。
②写出实验b中生成蓝色沉淀的离子方程式:_______ 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_______ 。
(3)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
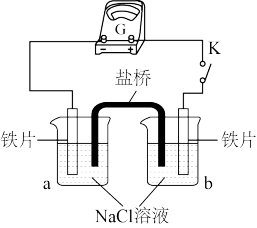
分别取少量容器a、b中的溶液于试管中,滴加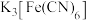 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,写出容器b中的电极反应式
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,写出容器b中的电极反应式________ 。
装置 | 分别进行的操作 | 现象 |
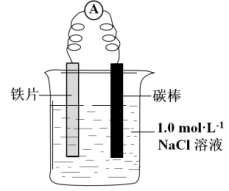 | i.连好装置一段时间后,向烧杯中滴加酚酞 | |
| ii.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
①实验i中的现象是
②写出实验b中生成蓝色沉淀的离子方程式:
(2)查阅资料:K3[Fe(CN)6]具有氧化性。据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是
(3)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

分别取少量容器a、b中的溶液于试管中,滴加
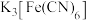 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,写出容器b中的电极反应式
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,写出容器b中的电极反应式
您最近一年使用:0次
名校
解题方法
10 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g)ΔH3=-297kJ·mol-1
反应Ⅱ的化学方程式为___ ,标准状况下每有6.72L的SO2发生反应,释放的能量为___ kJ。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
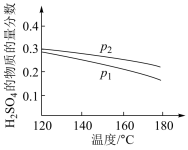
p2___ p1(填“>”或“<”),得出该结论的理由是___ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i.SO2+4H++4I-=S↓+2I2+2H2O
ii.I2+2H2O+SO2=4H++4I-+SO
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。
①C是A的对比实验,则a=___ 。
②设计实验B、C的目的:___ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g)ΔH3=-297kJ·mol-1
反应Ⅱ的化学方程式为
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i.SO2+4H++4I-=S↓+2I2+2H2O
ii.I2+2H2O+SO2=4H++4I-+SO

探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。
| 序号 | A | B | C |
| 试剂组成 | 0.4mol·L-1KI | 0.2mol·L-1H2SO4 | amol·L-1KI,0.2mol·L-1 H2SO4 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 无明显现象 | 溶液变黄,出现浑浊较A快 |
②设计实验B、C的目的:
您最近一年使用:0次



