1 . 用如图所示的装置测定中和反应反应热。
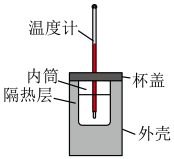
实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。
已知弱碱电离时吸热。回答下列问题。
(1)从实验装置上看,还缺少_____ ,其能否用铜质材料替代?_____ (填“能”或“不能”),理由是_____ 。
(2)装置中隔热层的作用是_____ 。
(3)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:
①两组实验结果存在差异的原因是_____ 。
②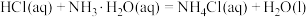 的
的
_____ (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热 偏大,则可能的原因是
偏大,则可能的原因是_____ (填序号)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____ (填“相等”“不相等”),若实验操作均正确,则所求中和热_____ (填“相等”“不相等”)。

实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。
已知弱碱电离时吸热。回答下列问题。
(1)从实验装置上看,还缺少
(2)装置中隔热层的作用是
(3)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:| 反应物 | 起始温度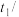 ℃ ℃ | 最高温度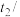 ℃ ℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
②
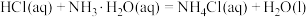 的
的
③某同学利用上述装置重新做甲组实验,测得反应热
 偏大,则可能的原因是
偏大,则可能的原因是A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
名校
2 . 药物异搏定合成路线中的某一步反应如图所示(部分产物未给出),下列说法正确的是
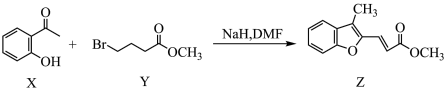
| A.X分子中一定共面的碳原子有8个 |
| B.有机物X可发生取代、加成、氧化反应 |
| C.Y在碱性溶液中反应可用于生产肥皂 |
| D.1 mol有机物Z与足量的氢气发生加成反应最多可消耗6 mol氢气 |
您最近一年使用:0次
2024-04-05更新
|
1263次组卷
|
9卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学2024届四川省成都外国语学校高三下学期高考模拟(一)考试理综试题-高中化学(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题(已下线)压轴题08?有机物的结构与性质(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)2024届四川省成都市第七中学高三下学期5月模拟考试理科综合试题-高中化学(已下线)单项选择题6-10(已下线)不定选择题11-152024届四川省射洪中学校高三下学期考前热身理综试题-高中化学
名校
解题方法
3 . 一种合金钢主要是铬和镍。这两种元素在元素周期表中位于
| A.s区 | B.p区 | C.d区 | D.ds区 |
您最近一年使用:0次
2024-04-04更新
|
60次组卷
|
2卷引用:四川省眉山市仁寿第一中学校南校区2023-2024学年高二下学期3月月考化学试题
4 . 中国传统文化及工艺对人类文明贡献巨大,我们应该弘扬与尊崇。下列说法中正确的是
A.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为[ ]),孔雀石颜料的主要成分为碱 ]),孔雀石颜料的主要成分为碱 |
| B.明代《菽园杂记》中对海水提取食盐有如下记载:烧草为灰,布在摊场,然后以海水渍之,侯晒结浮白,扫而复淋。上述涉及的“灰”为纯净物 |
C.我国化学家侯德榜先生于1943年创立了著名的侯氏制碱法,该工艺过程中应用了物质溶解度的差异,先析出了 晶体 晶体 |
| D.“青蒿一握,以水二升渍,绞取汁”,描述的是青蒿素的提取,属于化学变化 |
您最近一年使用:0次
2024-04-04更新
|
150次组卷
|
2卷引用:四川省眉山北外附属东坡外国语学校2023-2024学年高一下学期开学化学试题
名校
5 . 新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液(有效成分 );②
);② (在水中一部分可以电离出阴、阳离子);③漂白粉;④
(在水中一部分可以电离出阴、阳离子);③漂白粉;④ ;⑤
;⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸(
酒精;⑧过氧乙酸( );⑨高铁酸钠(
);⑨高铁酸钠( )。回答下列问题:
)。回答下列问题:
(1)上述杀菌消毒剂属于电解质的是___________ (填序号)。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用导致游泳池藻类快速生长,池水变绿,写出该反应的化学方程式___________ 。
(3)实验室可用 溶液配制消毒液。
溶液配制消毒液。
①需要用托盘天平称量 固体的质量为
固体的质量为___________  ;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有
;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有___________ 。
②下列情况会导致所配制溶液浓度偏高的是___________ (填标号)。
a.称量时所用的砝码生锈
b.移液时,有少量液体浅出
c.定容时,俯视刻度线
(4)高铁酸钠 是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体:
是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体: 。当反应转移电子的数目是
。当反应转移电子的数目是 时,生成标准状况下
时,生成标准状况下 的体积约为
的体积约为___________ 。用 代替
代替 处理饮用水的优点是
处理饮用水的优点是___________ (只答一条即可)。
 );②
);② (在水中一部分可以电离出阴、阳离子);③漂白粉;④
(在水中一部分可以电离出阴、阳离子);③漂白粉;④ ;⑤
;⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸(
酒精;⑧过氧乙酸( );⑨高铁酸钠(
);⑨高铁酸钠( )。回答下列问题:
)。回答下列问题:(1)上述杀菌消毒剂属于电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用导致游泳池藻类快速生长,池水变绿,写出该反应的化学方程式
(3)实验室可用
 溶液配制消毒液。
溶液配制消毒液。①需要用托盘天平称量
 固体的质量为
固体的质量为 ;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有
;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有②下列情况会导致所配制溶液浓度偏高的是
a.称量时所用的砝码生锈
b.移液时,有少量液体浅出
c.定容时,俯视刻度线
(4)高铁酸钠
 是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体:
是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体: 。当反应转移电子的数目是
。当反应转移电子的数目是 时,生成标准状况下
时,生成标准状况下 的体积约为
的体积约为 代替
代替 处理饮用水的优点是
处理饮用水的优点是
您最近一年使用:0次
名校
解题方法
6 . 一种回收锌电解阳极泥(主要成分为 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:

已知:① 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
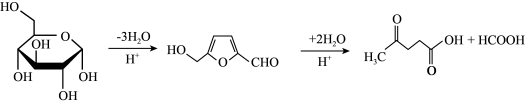
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
(1)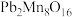 中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为_______ 。
(2)滤液1中的溶质为_______ ;“还原酸浸”过程中主要反应的化学方程式为_______ ;实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_______ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是_______ 、_______ ,用_______ (填物质的名称)洗涤、干燥。

(4)“电解”时,加入 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为_______ 。
(5)整个流程中可循环利用的物质是_______ 。
(6)通过计算说明可用 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因_______ 。[已知:25℃时 ,
,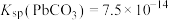 ]
]
 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物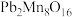 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
已知:①
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

(1)
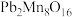 中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为(2)滤液1中的溶质为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是
(4)“电解”时,加入
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(5)整个流程中可循环利用的物质是
(6)通过计算说明可用
 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因 ,
,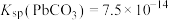 ]
]
您最近一年使用:0次
2024-04-04更新
|
643次组卷
|
3卷引用:2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学
2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学
名校
解题方法
7 . 随着原子序数的递增,8种短周期元素(用英文字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示:

(1)这8种元素中,金属性最强的元素在周期表中的位置是___________ 。
(2)元素z、d、e、f形成的简单离子,半径最大的离子是___________ (填离子符号)。
(3)将化合物eh由固态加热至熔融态,吸收的能量主要用于断裂___________ 键(填“离子”或“共价”);x与d可形成多种共价分子,其中三核共价分子的结构式为___________ ;四核共价分子的电子式为___________ 。
(4)不能作为g与h非金属性强弱判据的是___________。
(5)元素f的氧化物与e的最高价氧化物对应水化物发生反应的离子方程式为___________ 。

(1)这8种元素中,金属性最强的元素在周期表中的位置是
(2)元素z、d、e、f形成的简单离子,半径最大的离子是
(3)将化合物eh由固态加热至熔融态,吸收的能量主要用于断裂
(4)不能作为g与h非金属性强弱判据的是___________。
| A.氢化物酸性h强于g |
B.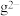 的还原性强于 的还原性强于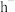 |
| C.与x单质反应,g单质比h单质更困难 |
| D.常温下g单质呈固态,h单质呈气态 |
(5)元素f的氧化物与e的最高价氧化物对应水化物发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为_______ ;基态 较基态
较基态 更稳定的原因是
更稳定的原因是_______ 。
(2) 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有_______ 个;C、N、F的电负性由大到小的顺序为_______ 。
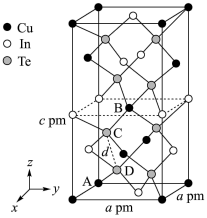
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为_______ ;该晶体的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为(0,0,0)、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ ,晶胞中C、D间距离
_______ pm。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为 较基态
较基态 更稳定的原因是
更稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C.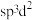 | D. |
(3)
 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 ,则C点原子的分数坐标为
,则C点原子的分数坐标为

您最近一年使用:0次
2024-04-04更新
|
701次组卷
|
3卷引用:2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学
2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学
9 . 氧化还原反应在生产生活中有很多实际应用。
I.高铁酸钾( )是一种新型绿色消毒剂,具有强氧化性,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
)是一种新型绿色消毒剂,具有强氧化性,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到 ,反应为:
,反应为: ,该反应的氧化产物是
,该反应的氧化产物是___________ ;每生成 转移电子数目为
转移电子数目为___________ 。
(2)湿法制备高铁酸钾( )的反应体系中有六种数粒:
)的反应体系中有六种数粒: 、
、 、
、 、
、 、
、 、
、 写出并配平湿法制高铁酸钾的离子反应方程式并用单线桥表示出电子转移的方向和数目:
写出并配平湿法制高铁酸钾的离子反应方程式并用单线桥表示出电子转移的方向和数目:___________ 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和也可制得高铁酸钾( )固体,请解释其原因
)固体,请解释其原因___________ 。
(4)高铁酸钾能用于处理饮用水的原因?___________ 、___________ 。
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的 有剧毒。在微生物的作用下,
有剧毒。在微生物的作用下, 能被氧气氧化成
能被氧气氧化成 同时生成
同时生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(6)试分析 反应中,被
反应中,被 氧化的P的物质的量为
氧化的P的物质的量为___________ 。
I.高铁酸钾(
 )是一种新型绿色消毒剂,具有强氧化性,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
)是一种新型绿色消毒剂,具有强氧化性,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。(1)干法制备高铁酸钾时,先制备得到
 ,反应为:
,反应为: ,该反应的氧化产物是
,该反应的氧化产物是 转移电子数目为
转移电子数目为(2)湿法制备高铁酸钾(
 )的反应体系中有六种数粒:
)的反应体系中有六种数粒: 、
、 、
、 、
、 、
、 、
、 写出并配平湿法制高铁酸钾的离子反应方程式并用单线桥表示出电子转移的方向和数目:
写出并配平湿法制高铁酸钾的离子反应方程式并用单线桥表示出电子转移的方向和数目:(3)低温下,在高铁酸钠溶液中加入KOH至饱和也可制得高铁酸钾(
 )固体,请解释其原因
)固体,请解释其原因(4)高铁酸钾能用于处理饮用水的原因?
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的
 有剧毒。在微生物的作用下,
有剧毒。在微生物的作用下, 能被氧气氧化成
能被氧气氧化成 同时生成
同时生成 ,该反应的离子方程式为
,该反应的离子方程式为(6)试分析
 反应中,被
反应中,被 氧化的P的物质的量为
氧化的P的物质的量为
您最近一年使用:0次
名校
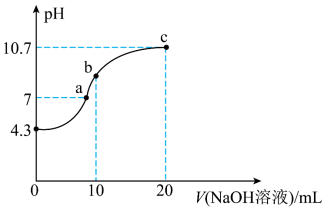
10 . I.连二次硝酸(H2N2O2)是一种二元酸。可用于制NO气体。常温下,用0.01 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
(1)N的价层电子排布图为:_______ 。
(2)常温下H2N2O2的Ka1为_______ 。
(3)b点时溶液中
_______  (填“>”“﹤”“=”,下同)。
(填“>”“﹤”“=”,下同)。
(4)a、b、c三点,水的电离程度最小的是_______ 。
II.25℃时,有浓度均为0.10 的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。
的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。
(5)这4种溶液pH由小到大的顺序是_______ (填序号)。
(6)①中各离子浓度由小到大的顺序是_______ 。
(7)CH3COOH和CH3COONa混合溶液中,若溶液pH=6,则溶液中
_______  (填精确值)。
(填精确值)。
 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
(1)N的价层电子排布图为:
(2)常温下H2N2O2的Ka1为
(3)b点时溶液中

 (填“>”“﹤”“=”,下同)。
(填“>”“﹤”“=”,下同)。(4)a、b、c三点,水的电离程度最小的是
II.25℃时,有浓度均为0.10
 的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。
的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。| HCN | H2CO3 | CH3COOH |
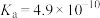 |  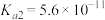 |  |
(6)①中各离子浓度由小到大的顺序是
(7)CH3COOH和CH3COONa混合溶液中,若溶液pH=6,则溶液中

 (填精确值)。
(填精确值)。
您最近一年使用:0次



