1 . 常温下,二元弱酸 体系中
体系中 [其中X表示
[其中X表示 或
或 ]随溶液
]随溶液 变化如图所示(通过加入
变化如图所示(通过加入 固体调节溶液
固体调节溶液 且忽略溶液体积变化)。下列说法中错误的是
且忽略溶液体积变化)。下列说法中错误的是
 体系中
体系中 [其中X表示
[其中X表示 或
或 ]随溶液
]随溶液 变化如图所示(通过加入
变化如图所示(通过加入 固体调节溶液
固体调节溶液 且忽略溶液体积变化)。下列说法中错误的是
且忽略溶液体积变化)。下列说法中错误的是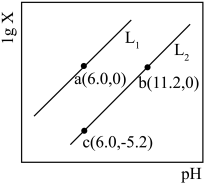
A. 表示 表示 随溶液 随溶液 的变化 的变化 |
B.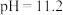 的溶液中存在 的溶液中存在 |
C.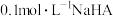 溶液中存在 溶液中存在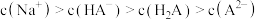 |
D.水的电离程度: |
您最近一年使用:0次
2024-06-08更新
|
37次组卷
|
2卷引用:2024届陕西省安康市高新中学、安康中学高新分校高三下学期模拟预测(三)理综试题-高中化学
2 . 化学与生活息息相关,下列说法错误的是
| A.生活用品中加入银离子可有效防护细菌侵入 |
| B.铁粉可用作食品包装袋中的脱氧剂 |
| C.航天员手臂“延长器”中的碳纤维是无机非金属材料 |
| D.从石墨中剥离出的石墨烯薄片能导电,是一种电解质 |
您最近一年使用:0次
名校
解题方法
3 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓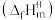 数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
则

_______  ,该反应在
,该反应在_______ (填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①: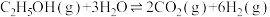
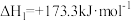
反应②:
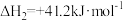
(2)向恒容密闭容器中充入1mol 和3mol
和3mol  发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时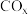 的分布分数
的分布分数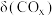 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。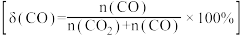
_______ (写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:_______ 。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内
___  ,该温度下,反应②的
,该温度下,反应②的
_______ (保留小数点后两位)。
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:_______ ,当转移1.2mol电子时,正极消耗的氧气的体积为_______ L(标准状况下)。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓
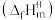 数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。| 物质 |  |  |  |  |
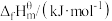 | 0 | -393.5 | -241.8 | -200.7 |


 ,该反应在
,该反应在Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①:
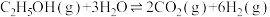
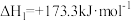
反应②:

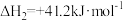
(2)向恒容密闭容器中充入1mol
 和3mol
和3mol  发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时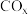 的分布分数
的分布分数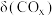 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。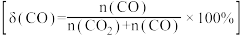

②200℃以后,解释曲线a随温度变化趋势的原因:
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内

 ,该温度下,反应②的
,该温度下,反应②的
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:

您最近一年使用:0次
2024-06-08更新
|
149次组卷
|
3卷引用:2024年陕西省西安市鄠邑区第二中学高三模拟考试理综试卷-高中化学
4 .  NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL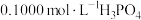 溶液时,
溶液时,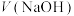 、各含磷元素微粒的
、各含磷元素微粒的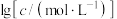 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是
 NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL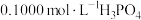 溶液时,
溶液时,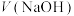 、各含磷元素微粒的
、各含磷元素微粒的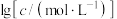 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是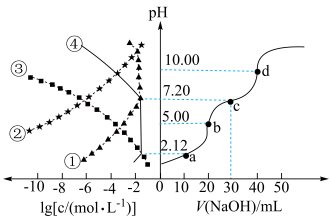
A. 的 的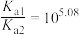 |
| B.水的电离程度:d>c>b>a |
C.③为 的 的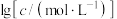 与pH的关系 与pH的关系 |
D.c点时,溶液中存在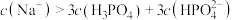 |
您最近一年使用:0次
2024-06-08更新
|
178次组卷
|
4卷引用:2024年陕西省西安市鄠邑区第二中学高三模拟考试理综试卷-高中化学
名校
解题方法
5 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.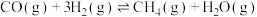

ii.

iii.

回答下列问题:
(1)在25℃和101kPa下, 转变为
转变为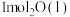 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
________  。
。
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的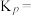
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
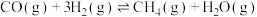

ii.


iii.


回答下列问题:
(1)在25℃和101kPa下,
 转变为
转变为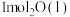 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。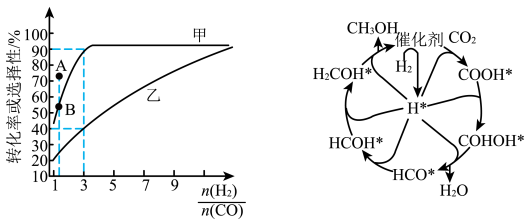
 选择性变化的曲线是
选择性变化的曲线是 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为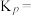
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
2024-06-08更新
|
229次组卷
|
7卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
名校
解题方法
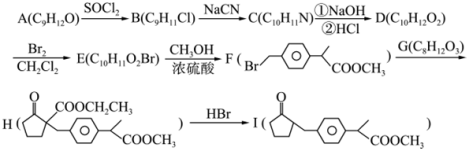
6 . 有机物I是制备抗炎镇痛药洛索洛芬钠的重要中间体,其一种合成路线如下:
(1)A→B的反应类型为________ ,H中含氧官能团的名称为________ 。
(2)E→F的化学方程式为________ 。
(3)G的结构简式为________ ,用*标出I中的手性碳原子________ 。
(4)D的芳香族同分异构体中,核磁共振氢谱有4组峰,红外光谱显示有 的结构有
的结构有________ 种。
(5)根据上述信息,以苯和甲醛为主要原料制备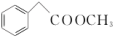 的合成路线
的合成路线________ 。
已知:
(1)A→B的反应类型为
(2)E→F的化学方程式为
(3)G的结构简式为
(4)D的芳香族同分异构体中,核磁共振氢谱有4组峰,红外光谱显示有
 的结构有
的结构有(5)根据上述信息,以苯和甲醛为主要原料制备
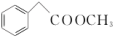 的合成路线
的合成路线
您最近一年使用:0次
2024-06-08更新
|
297次组卷
|
7卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
解题方法
7 . 化合物M是一种制造压塑粉的原料,结构简式如图所示,其组成元素X、Y、Z、W位于短周期,原子序数依次增大且满足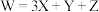 。下列说法错误的是
。下列说法错误的是
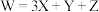 。下列说法错误的是
。下列说法错误的是
A.原子半径: |
B.氧化物对应水化物的酸性: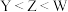 |
| C.W与钠元素形成的化合物水溶液显碱性 |
| D.W、Z分别与X形成的简单化合物可发生反应 |
您最近一年使用:0次
解题方法
8 . 萘普生是一种常用消炎药,具有解热、镇痛作用,其结构简式如图所示,其中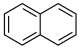 为萘环,下列关于萘普生的说法错误的是
为萘环,下列关于萘普生的说法错误的是

A.分子式为 |
| B.能发生酯化反应和加成反应 |
| C.分子中所有碳原子可能共平面 |
| D.萘环上的一氯代物有6种(不考虑立体异构) |
您最近一年使用:0次
解题方法
9 . 丙烯是一种重要的化工原料,工业上丙烷制丙烯的相关反应如下:
ⅰ.
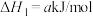
ⅱ.

ⅲ.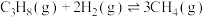
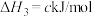
回答下列问题:
Ⅰ.单独投料(副反应抑制法)。
(1)反应: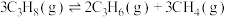

_________  。
。
(2) 时,单独加入
时,单独加入 至
至 后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数
后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数 见下表。
见下表。
①若只考虑体系中反应ⅱ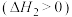 ,以下操作有利于减小
,以下操作有利于减小 平衡转化率的是
平衡转化率的是___________ (填字母)。
A.通入少量 B.使用高选择性催化剂 C.降温 D.减压
B.使用高选择性催化剂 C.降温 D.减压
② 内
内 消耗的平均速率:反应ⅰ
消耗的平均速率:反应ⅰ_________ 反应ⅱ(填“<”、“>”或“=”)。
(3)一定温度下,向 恒容密闭容器中通入
恒容密闭容器中通入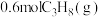 ,压强为
,压强为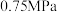 ,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数
,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 ,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
___________ 。
Ⅱ.共进料投料(耦合反应法)。
工业上也常采用 与
与 共进料投料,通过发生耦合反应制丙烯,反应如下:
共进料投料,通过发生耦合反应制丙烯,反应如下:
(4) 为用压强表示的反应平衡常数,一定温度下:
为用压强表示的反应平衡常数,一定温度下:
ⅰ.
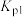
ⅳ.
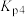
则体系中反应

___________ (用含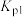 、
、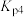 的式子表示)。
的式子表示)。
(5)实际工艺生产中按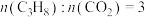 进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:________ (填“吸热”或“放热”)反应,在________ (填“高温”或“低温”)下进行自发反应。
②生产中温度须不低于 ,原因是
,原因是___________ 。
ⅰ.

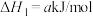
ⅱ.


ⅲ.
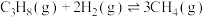
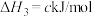
回答下列问题:
Ⅰ.单独投料(副反应抑制法)。
(1)反应:
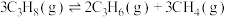

 。
。(2)
 时,单独加入
时,单独加入 至
至 后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数
后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数 见下表。
见下表。| 物质 |  |  |  |  |
体积分数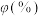 | 18 | 20 | 47 | 0 |
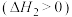 ,以下操作有利于减小
,以下操作有利于减小 平衡转化率的是
平衡转化率的是A.通入少量
 B.使用高选择性催化剂 C.降温 D.减压
B.使用高选择性催化剂 C.降温 D.减压②
 内
内 消耗的平均速率:反应ⅰ
消耗的平均速率:反应ⅰ(3)一定温度下,向
 恒容密闭容器中通入
恒容密闭容器中通入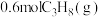 ,压强为
,压强为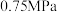 ,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数
,若只考虑反应ⅰ、ⅱ,反应后测得各组分的平衡压强(即组分的物质的量分数 总压)为
总压)为 、
、 ,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
,则该温度下,用物质的量浓度表示反应Ⅰ的平衡常数
Ⅱ.共进料投料(耦合反应法)。
工业上也常采用
 与
与 共进料投料,通过发生耦合反应制丙烯,反应如下:
共进料投料,通过发生耦合反应制丙烯,反应如下:
(4)
 为用压强表示的反应平衡常数,一定温度下:
为用压强表示的反应平衡常数,一定温度下:ⅰ.

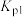
ⅳ.

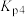
则体系中反应


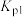 、
、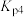 的式子表示)。
的式子表示)。(5)实际工艺生产中按
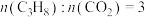 进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析: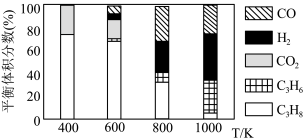
②生产中温度须不低于
 ,原因是
,原因是
您最近一年使用:0次
名校
10 . 化合物G是一种药物合成中间体,其一种合成路线如下:
(1)C中含氧官能团的名称为__________ ,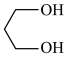 的系统命名为
的系统命名为___________ 。
(2)B→C的反应类型为__________ ;反应C→D的化学方程式为_______________ 。
(3)设计A→B的目的是____________________________ 。
(4)若F→G的反应经历F→X→G的过程,已知X的分子式为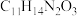 ,则X的结构简式为
,则X的结构简式为_______________ ,X→G的反应类型为_______________ 。
(5)E→F的反应中, 的作用是
的作用是____________________ 。
(6)化合物K是A的同系物且化合物K比化合物A多一个碳原子,满足以下条件的K的同分异构体有________ 种(不考虑立体异构),其中核磁共振氢谱峰面积之比为1∶2∶2∶2的结构简式为_____________ (写一种)。
1mol K的同分异构体与足量碳酸氢钠溶液反应,可以生成2mol 。
。
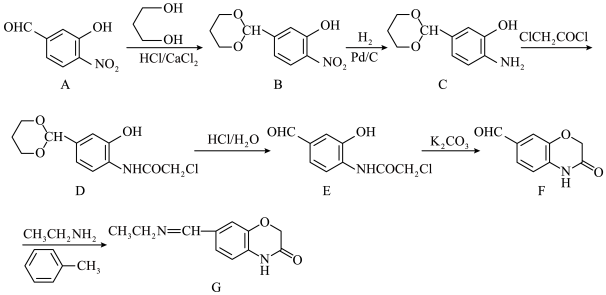
(1)C中含氧官能团的名称为
 的系统命名为
的系统命名为(2)B→C的反应类型为
(3)设计A→B的目的是
(4)若F→G的反应经历F→X→G的过程,已知X的分子式为
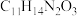 ,则X的结构简式为
,则X的结构简式为(5)E→F的反应中,
 的作用是
的作用是(6)化合物K是A的同系物且化合物K比化合物A多一个碳原子,满足以下条件的K的同分异构体有
1mol K的同分异构体与足量碳酸氢钠溶液反应,可以生成2mol
 。
。
您最近一年使用:0次
2024-06-07更新
|
97次组卷
|
2卷引用:2024届陕西省铜川市王益中学高三下学期模拟预测理综试题-高中化学



