解题方法
1 . 石油化工生产过程中,将石油分馏产物中长链烃的裂解产物进行分离,就可以得到合成纤维工业、塑料工业、橡胶工业等重要的短链烃化工原料。
(1)已知:正丁烷和异丁烷之间转化的能量变化如图1所示。___________ 。
(2)已知: 、
、 、
、 的键能分别为:
的键能分别为: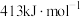 、
、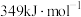 、
、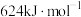 。
。
反应1: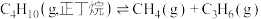

反应2: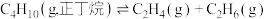

①裂解反应1在___________ (填“高温”、“低温”或“任何温度”)下能自发进行;
②裂解反应2的正反应活化能___________ (填“ ”或“
”或“ ”)逆反应活化能。
”)逆反应活化能。
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率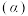 与压强
与压强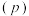 和温度
和温度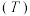 的关系如图2所示。
的关系如图2所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是___________ 。
(4)温度T°C下,向2L密闭容器中投入正丁烷,同时发生反应1和反应2.6min达到平衡,测得部分物质的浓度与时间的关系如图3所示,平衡时体系的压强为51MPa。
①0~6min内,利用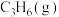 表示的平均反应速率为
表示的平均反应速率为___________  。
。
②7min时改变的条件可能是___________ (填字母)。
A.缩小容器的体积 B.降低温度 C.增大正丁烷的浓度 D.加入催化剂
③温度T°C下,反应2的分压平衡常数
___________ MPa。
(1)已知:正丁烷和异丁烷之间转化的能量变化如图1所示。

(2)已知:
 、
、 、
、 的键能分别为:
的键能分别为: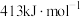 、
、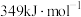 、
、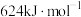 。
。反应1:
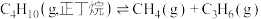

反应2:
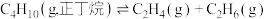

①裂解反应1在
②裂解反应2的正反应活化能
 ”或“
”或“ ”)逆反应活化能。
”)逆反应活化能。(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率
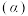 与压强
与压强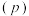 和温度
和温度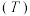 的关系如图2所示。
的关系如图2所示。
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是
(4)温度T°C下,向2L密闭容器中投入正丁烷,同时发生反应1和反应2.6min达到平衡,测得部分物质的浓度与时间的关系如图3所示,平衡时体系的压强为51MPa。

①0~6min内,利用
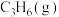 表示的平均反应速率为
表示的平均反应速率为 。
。②7min时改变的条件可能是
A.缩小容器的体积 B.降低温度 C.增大正丁烷的浓度 D.加入催化剂
③温度T°C下,反应2的分压平衡常数

您最近一年使用:0次
2 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂HF、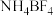 。
。
①基态F原子核外电子有___________ 种空间运动状态,下列为氟原子激发态的电子排布式的是___________ (填字母)。
A. B.
B.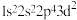 C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为___________ 。
③HF分子的极性___________ (填“大于”、“等于”或“小于”)HCl, 的空间构型为
的空间构型为___________ 。
④“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如下图所示,其中S原子的杂化方式为___________ 。 ,
, 与Mn原子配位时,提供孤电子对的是
与Mn原子配位时,提供孤电子对的是___________ (填元素符号),Mn原子的配位数为___________ , 中
中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图中钠原子沿z轴投影如图所示,已知m原子的分数坐标为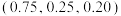 ,晶胞棱边夹角均为90°。n原子的分数坐标是
,晶胞棱边夹角均为90°。n原子的分数坐标是___________ ,若阿伏加德罗常数的值为 ,该晶体的密度是
,该晶体的密度是___________  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂HF、
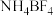 。
。①基态F原子核外电子有
A.
 B.
B.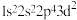 C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③HF分子的极性
 的空间构型为
的空间构型为④“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如下图所示,其中S原子的杂化方式为
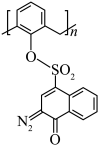
 ,
, 与Mn原子配位时,提供孤电子对的是
与Mn原子配位时,提供孤电子对的是 中
中 键与
键与 键数目之比为
键数目之比为(3)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图中钠原子沿z轴投影如图所示,已知m原子的分数坐标为
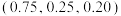 ,晶胞棱边夹角均为90°。n原子的分数坐标是
,晶胞棱边夹角均为90°。n原子的分数坐标是 ,该晶体的密度是
,该晶体的密度是 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。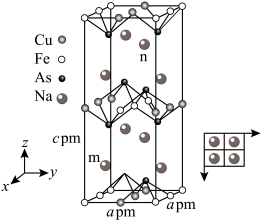
您最近一年使用:0次
解题方法
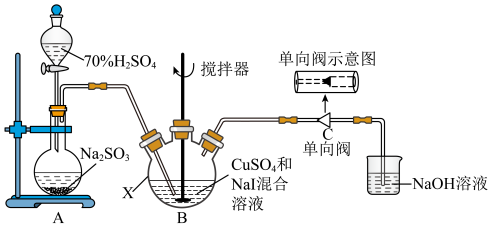
3 . 碘化亚铜(CuI)可用作有机合成催化剂,是一种白色粉末,不溶于水,在空气中相对稳定。实验室制备碘化亚铜的装置如图(部分夹持及加热装置已略去):
I.取50.0g 、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
Ⅱ.打开分液漏斗,将A中产生的 通向B中的黄色沉淀,充分反应后得到白色沉淀;
通向B中的黄色沉淀,充分反应后得到白色沉淀;
Ⅲ.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
Ⅳ.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前,必需进行的操作是___________ 。仪器X的名称是___________ 。
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为___________ 。
(3)步骤Ⅱ通入 的主要目的是
的主要目的是___________ 。写出通入 所发生的离子反应方程式
所发生的离子反应方程式___________ 。
(4)下图中能起到与单向阀C相同作用的是___________ (填字母)。(下图容器中未标注的液体均为氢氧化钠溶液) 浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为___________ %,据此推算CuI的产率接近于___________ (填字母)。
I.取50.0g
 、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;Ⅱ.打开分液漏斗,将A中产生的
 通向B中的黄色沉淀,充分反应后得到白色沉淀;
通向B中的黄色沉淀,充分反应后得到白色沉淀;Ⅲ.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
Ⅳ.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前,必需进行的操作是
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为
(3)步骤Ⅱ通入
 的主要目的是
的主要目的是 所发生的离子反应方程式
所发生的离子反应方程式(4)下图中能起到与单向阀C相同作用的是

 浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
您最近一年使用:0次
4 . 硅元素广泛应用于半导体、光伏、塑料工业。回答下列问题:
(1)同周期元素中,成对电子数比硅多的元素有___________ 种。
(2)晶体硅和碳化硅的熔点相比,较高的是___________ (填化学式),原因是___________ 。
(3)由于硅的价层有 轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 (三角锥形)中,更易形成配合物的是
(三角锥形)中,更易形成配合物的是___________ (填化学式)。 中元素的电负性由大到小的顺序是
中元素的电负性由大到小的顺序是___________ 。下列划线原子与 中
中 原子杂化类型相同的是
原子杂化类型相同的是___________ (填字母)。
A.COCl2 B.NH3·BH3 C.CH3NH2
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为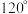 ,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。
,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。___________ ,已知该新型材料的摩尔质量为Mg/mol,阿伏加德罗常数的值用NA表示,则其密度为___________ g·cm-3(用含a、c、M、NA的代数式表示)。
(1)同周期元素中,成对电子数比硅多的元素有
(2)晶体硅和碳化硅的熔点相比,较高的是
(3)由于硅的价层有
 轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 (三角锥形)中,更易形成配合物的是
(三角锥形)中,更易形成配合物的是 中元素的电负性由大到小的顺序是
中元素的电负性由大到小的顺序是 中
中 原子杂化类型相同的是
原子杂化类型相同的是A.COCl2 B.NH3·BH3 C.CH3NH2
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为
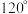 ,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。
,z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示,晶胞中碳原子的投影位置如图乙所示。
您最近一年使用:0次
解题方法
5 . X、Y、Z、M、R、Q为六种短周期元素,其原子半径和最外层电子数之间的关系如图所示,下列说法正确的是

| A.X、Z、M可形成一种离子化合物 | B.加热条件下,Q单质与M单质反应生成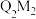 |
C.Y、M形成的化合物 为大气污染物 为大气污染物 | D.R的最高价氧化物对应的水化物为弱碱 |
您最近一年使用:0次
6 . 25℃时,向一定浓度的 溶液中滴加NaOH溶液,混合液中
溶液中滴加NaOH溶液,混合液中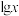 随pOH的变化如图所示,下列说法错误的是
随pOH的变化如图所示,下列说法错误的是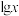 中x表示
中x表示 、
、 、
、 ;
;
② 。
。
 溶液中滴加NaOH溶液,混合液中
溶液中滴加NaOH溶液,混合液中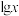 随pOH的变化如图所示,下列说法错误的是
随pOH的变化如图所示,下列说法错误的是
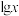 中x表示
中x表示 、
、 、
、 ;
;②
 。
。A.曲线III表示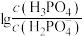 随pOH的变化关系 随pOH的变化关系 |
B.M点时,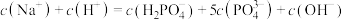 |
C.当溶液 时, 时, |
D. 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
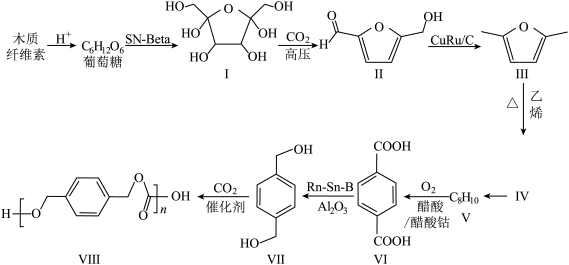
7 . 利用木质纤维素为起始原料结合(生产聚碳酸对二甲苯酯可以实现碳减排,缓解日益紧张的能源危机,路线如下:___________ 。
(2)Ⅰ分子中,手性碳(与四个各不相同的原子或基团相连的碳原子)的个数为___________ 。
(3)1mol化合物III与1mol乙烯反应得到1molIV,该反应原子利用率为100%,化合物IV的结构简式为___________ ,该反应的反应类型为___________ 。
(4)V分子的核磁共振氢谱的峰面积之比为___________ 。
(5)请写出VII生成VIII的化学反应方程式___________ 。
(6)化合物VII的芳香族同分异构体中符合下列条件的有___________ 种(不含立体异构)。
①最多能与相同物质的量的Na2CO3反应;②能与2倍物质的量的Na反应放出H2。
写出含有等效氢种类最少的同分异构体的结构简式___________ 。
已知: 。回答下列问题:
。回答下列问题:
(2)Ⅰ分子中,手性碳(与四个各不相同的原子或基团相连的碳原子)的个数为
(3)1mol化合物III与1mol乙烯反应得到1molIV,该反应原子利用率为100%,化合物IV的结构简式为
(4)V分子的核磁共振氢谱的峰面积之比为
(5)请写出VII生成VIII的化学反应方程式
(6)化合物VII的芳香族同分异构体中符合下列条件的有
①最多能与相同物质的量的Na2CO3反应;②能与2倍物质的量的Na反应放出H2。
写出含有等效氢种类最少的同分异构体的结构简式
您最近一年使用:0次
解题方法
8 . X、Y、Z、W、M为原子序数依次增大的短周期主族元素。由这5种元素组成的某化合物是电池工业中的重要原料,该化合物的结构式如图所示。下列说法正确的是
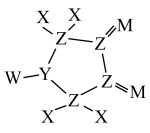
| A.原子半径:Y<Z<W |
| B.最高价含氧酸的酸性:Z>M |
| C.该化合物中除X外,其余原子均满足8电子稳定结构 |
| D.单质的熔点:W<M |
您最近一年使用:0次
解题方法
9 . 已知X、Y、Z、W是原子序数依次递增的短周期主族元素。其中,X、W同主族;Y原子的内层电子总数是其最外层电子数的 ,而Z原子最外层电子数与Y原子最外层电子数之比为3:2,Y与乙的质子数之和比X与W的质子数之和大。下列说法错误的是
,而Z原子最外层电子数与Y原子最外层电子数之比为3:2,Y与乙的质子数之和比X与W的质子数之和大。下列说法错误的是
 ,而Z原子最外层电子数与Y原子最外层电子数之比为3:2,Y与乙的质子数之和比X与W的质子数之和大。下列说法错误的是
,而Z原子最外层电子数与Y原子最外层电子数之比为3:2,Y与乙的质子数之和比X与W的质子数之和大。下列说法错误的是| A.简单离子半径:Z>W>X |
| B.元素X与Z形成的二元化合物可能含有非极性键 |
| C.由X、Y、Z、W四种元素组成的物质一定属于酸式盐 |
D.W单质在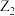 中燃烧生成淡黄色固体 中燃烧生成淡黄色固体 |
您最近一年使用:0次
解题方法
10 . 设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.46g 和 和 的混合气体中所含原子的数目为1.5 的混合气体中所含原子的数目为1.5 |
B.室温下, 的氨水和氢氧化钠混合溶液中含 的氨水和氢氧化钠混合溶液中含 的数目为0.1 的数目为0.1 |
C.标准状况下,1molFe与22.4L 完全反应时则转移电子数目为3 完全反应时则转移电子数目为3 |
D.常温常压下,1mol氦气中含有的原子数为 |
您最近一年使用:0次



