名校
解题方法
1 . 连二硫酸锰( )常用于灭菌以及水果、蔬菜的保鲜,利用
)常用于灭菌以及水果、蔬菜的保鲜,利用 悬浊液吸收
悬浊液吸收 气体制取连二硫酸锰的装置(部分夹持、控温仪器已省略)如图所示:
气体制取连二硫酸锰的装置(部分夹持、控温仪器已省略)如图所示:
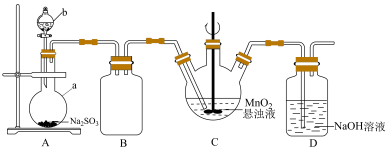
已知:
i. 易溶于水,其在
易溶于水,其在 为2.8~3.5时最稳定,温度超过
为2.8~3.5时最稳定,温度超过 时会快速分解生成易溶于水的
时会快速分解生成易溶于水的 ;
;
ii.连二硫酸的结构式: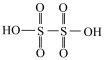 。
。
(1) 中
中 的化合价为
的化合价为___________ 。
(2)仪器a的名称是___________ ,仪器b装入的药品是___________ (填标号)。
A.浓盐酸 B.浓硝酸 C.稀硝酸 D.70%硫酸溶液
(3)装置B的作用为___________ 。
(4)装置C中的反应温度需要控制在左右,实验时需通入稍过量的 ,目的是
,目的是___________ ;表明C中反应已完成的现象是___________ 。
(5)测定产品中 元素的质量分数:称取
元素的质量分数:称取 产品充分加热使其分解为
产品充分加热使其分解为 ,然后加水溶解,用
,然后加水溶解,用 的酸性
的酸性 溶液进行滴定(
溶液进行滴定( 元素均转化为
元素均转化为 )。若多次滴定平均消耗
)。若多次滴定平均消耗 溶液的体积为
溶液的体积为 ,则产品中
,则产品中 元素的质量分数为
元素的质量分数为___________ (用含 、
、 、
、 的代数式表示)。滴定过程中发生反应的离子方程式为
的代数式表示)。滴定过程中发生反应的离子方程式为___________ 。
 )常用于灭菌以及水果、蔬菜的保鲜,利用
)常用于灭菌以及水果、蔬菜的保鲜,利用 悬浊液吸收
悬浊液吸收 气体制取连二硫酸锰的装置(部分夹持、控温仪器已省略)如图所示:
气体制取连二硫酸锰的装置(部分夹持、控温仪器已省略)如图所示:
已知:
i.
 易溶于水,其在
易溶于水,其在 为2.8~3.5时最稳定,温度超过
为2.8~3.5时最稳定,温度超过 时会快速分解生成易溶于水的
时会快速分解生成易溶于水的 ;
;ii.连二硫酸的结构式:
 。
。(1)
 中
中 的化合价为
的化合价为(2)仪器a的名称是
A.浓盐酸 B.浓硝酸 C.稀硝酸 D.70%硫酸溶液
(3)装置B的作用为
(4)装置C中的反应温度需要控制在左右,实验时需通入稍过量的
 ,目的是
,目的是(5)测定产品中
 元素的质量分数:称取
元素的质量分数:称取 产品充分加热使其分解为
产品充分加热使其分解为 ,然后加水溶解,用
,然后加水溶解,用 的酸性
的酸性 溶液进行滴定(
溶液进行滴定( 元素均转化为
元素均转化为 )。若多次滴定平均消耗
)。若多次滴定平均消耗 溶液的体积为
溶液的体积为 ,则产品中
,则产品中 元素的质量分数为
元素的质量分数为 、
、 、
、 的代数式表示)。滴定过程中发生反应的离子方程式为
的代数式表示)。滴定过程中发生反应的离子方程式为
您最近一年使用:0次
2023-12-16更新
|
262次组卷
|
2卷引用:湖南师范大学附属中学2023-2024学年高三上学期月考卷(四)化学试题
名校
解题方法
2 . 某同学探究外界条件对 分解速率的影响。
分解速率的影响。
实验所用试剂: 溶液、蒸馏水、
溶液、蒸馏水、 粉末、
粉末、 粉。
粉。
(1)实验1、2的目的是其他条件相同时,研究_______ 对 分解速率的影响。该因素可以改变单位体积内的
分解速率的影响。该因素可以改变单位体积内的_______ (填标号),从而改变分解速率。
A.活化分子数 B.活化分子百分数 C.分子总数
(2)表中a处所用试剂为_______ 。对比实验3、4可得出的结论是_______ 。
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用 溶液,还应添加的试剂及用量为
溶液,还应添加的试剂及用量为_______ 。
(4)控制其他条件相同,印刷电路板的金属粉末用 ,溶液和
,溶液和 溶液处理。
溶液处理。
①请配平方程式:_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:_______ 。
 分解速率的影响。
分解速率的影响。实验所用试剂:
 溶液、蒸馏水、
溶液、蒸馏水、 粉末、
粉末、 粉。
粉。| 实验 序号 |  浓度 浓度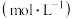 |  ( ( 溶液) 溶液) | 温度 | 催化剂 | 收集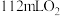 所需时间 所需时间 |
| 1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
| 2 | 0.4 | 20 | 50℃水浴 | 无 | 296 |
| 3 | 0.4 | 20 | 室温 |  | 45 |
| 4 | 0.4 | 20 | 室温 |  粉末 粉末 | 100 |
| 5 | 0.4 | b | 室温 | a |  |
 分解速率的影响。该因素可以改变单位体积内的
分解速率的影响。该因素可以改变单位体积内的A.活化分子数 B.活化分子百分数 C.分子总数
(2)表中a处所用试剂为
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用
 溶液,还应添加的试剂及用量为
溶液,还应添加的试剂及用量为(4)控制其他条件相同,印刷电路板的金属粉末用
 ,溶液和
,溶液和 溶液处理。
溶液处理。①请配平方程式:
_______
 _______
_______ _______
_______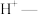 _______
_______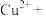 _______
_______
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
您最近一年使用:0次
名校
解题方法
3 . 某同学做实验时不小心沾了一些 在皮肤上,使皮肤上形成了黑斑,这些黑斑要很久才能消失,如果用草酸的稀溶液洗涤马上就可以消失,涉及的反应的离子方程式为
在皮肤上,使皮肤上形成了黑斑,这些黑斑要很久才能消失,如果用草酸的稀溶液洗涤马上就可以消失,涉及的反应的离子方程式为 ___________(未配平)。下列关于此反应的叙述正确的是
___________(未配平)。下列关于此反应的叙述正确的是
 在皮肤上,使皮肤上形成了黑斑,这些黑斑要很久才能消失,如果用草酸的稀溶液洗涤马上就可以消失,涉及的反应的离子方程式为
在皮肤上,使皮肤上形成了黑斑,这些黑斑要很久才能消失,如果用草酸的稀溶液洗涤马上就可以消失,涉及的反应的离子方程式为 ___________(未配平)。下列关于此反应的叙述正确的是
___________(未配平)。下列关于此反应的叙述正确的是A.该反应的氧化产物是 | B. 在反应中失去 在反应中失去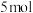 电子 电子 |
C.横线上应是 | D.该反应氧化剂与还原剂物质的量之比为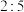 |
您最近一年使用:0次
4 . I.实验室由普通锌锰电池的锌皮[主要成分是Zn,还含有少量杂质Fe和粘附的Zn(NH3)2Cl2]为原料制取纳米氧化锌和鸟粪石(MgNH4PO4),其主要实验流程如下:
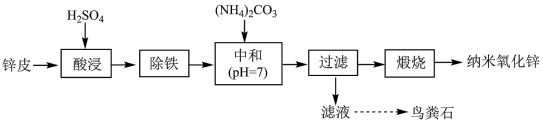
(1)“除铁”包括氧化和沉铁。“氧化”时,向“酸浸”后的溶液中加入过量的双氧水,反应的离子方程式为___________ ;检验“除铁”完全的实验操作是___________ 。
(2)将“过滤”后的滤液与MgSO4、Na2HPO4溶液反应,生成鸟粪石沉淀。
已知常温下:Ksp(MgNH4PO4)=2.5×10-13,Ksp[Mg3(PO4)2]=9.8×10-25,Ksp[Mg(OH)2]=1.8×10-11
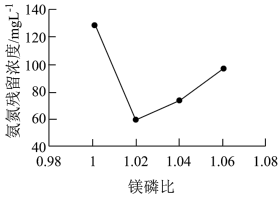
①镁磷比[ ]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是
]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是___________ 。
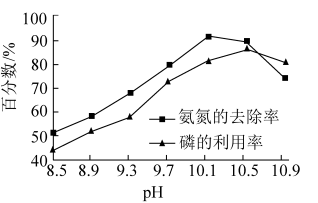
②镁磷比一定,氨氮的去除率和磷的利用率与溶液pH的关系如图所示。当pH为10.1~10.5时,除了生成鸟粪石外,还会生成___________ (填化学式);当pH>10.5时,氨氮去除率和磷的利用率均减小的原因是___________ 。
Ⅱ.室温下,向体积为2L的恒容密闭容器中通入4molH2和1molCO2发生Sabatier反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
(3)①0~10min内,v(CO2)=___________
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。20min时,
___________ 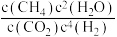 ;反应达平衡时,升高温度,k正增大的倍数
;反应达平衡时,升高温度,k正增大的倍数___________ k逆增大的倍数。(填“>”“<”或“=”)。

(1)“除铁”包括氧化和沉铁。“氧化”时,向“酸浸”后的溶液中加入过量的双氧水,反应的离子方程式为
(2)将“过滤”后的滤液与MgSO4、Na2HPO4溶液反应,生成鸟粪石沉淀。
已知常温下:Ksp(MgNH4PO4)=2.5×10-13,Ksp[Mg3(PO4)2]=9.8×10-25,Ksp[Mg(OH)2]=1.8×10-11
①镁磷比[
 ]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是
]与氨氮残留浓度的关系如图所示。当镁磷比小于1.02时,随镁磷比的增大,氨氮残留浓度减小的原因是
②镁磷比一定,氨氮的去除率和磷的利用率与溶液pH的关系如图所示。当pH为10.1~10.5时,除了生成鸟粪石外,还会生成

Ⅱ.室温下,向体积为2L的恒容密闭容器中通入4molH2和1molCO2发生Sabatier反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 5.00p | 4.60p | 4.30p | 4.15p | 4.06p | 4.00p | 4.00p |
(3)①0~10min内,v(CO2)=
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。20min时,

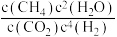 ;反应达平衡时,升高温度,k正增大的倍数
;反应达平衡时,升高温度,k正增大的倍数
您最近一年使用:0次
名校
5 . 填空
(1)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程:
①该反应中的还原剂是______ .
②该反应中,发生还原反应的过程是______ .
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目______ .
④如反应转移了0.3mol电子,则产生的气体在标准状况下体积为______ .
(2)在反应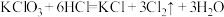 中,还原产物是
中,还原产物是______ ,反应中的氧化剂与还原剂物质的量之比为______ .
(1)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程:
①该反应中的还原剂是
②该反应中,发生还原反应的过程是
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
④如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(2)在反应
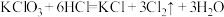 中,还原产物是
中,还原产物是
您最近一年使用:0次
解题方法
6 . 元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。如图是钠的价类二维图:
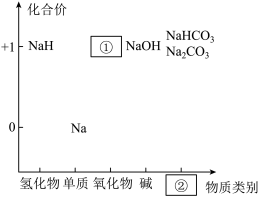
(1)②处应填的物质类别是___________ ;
(2)将钠放入水中发生反应的离子方程式是___________ ;
(3)Na可用石蜡封存,实验室少量Na保存于___________ 中;
(4)将Na2O2投入盛有CuSO4溶液的烧杯中,观察到的现象是___________(填标号);
(5)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:
____ +____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)
+____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)
首先请补全方程式并配平__________ ,然后回答反应中被还原的元素是___________ ;反应中每消耗1molNa2O2的同时有___________ mol电子转移。

(1)②处应填的物质类别是
(2)将钠放入水中发生反应的离子方程式是
(3)Na可用石蜡封存,实验室少量Na保存于
(4)将Na2O2投入盛有CuSO4溶液的烧杯中,观察到的现象是___________(填标号);
| A.有气体生成 | B.无气体生成 | C.有蓝色沉淀生成 | D.大量红色固体铜生成 |
(5)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:
____
 +____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)
+____Na2O2+______→ ______Mn2++______Na++_____+_____H2O(未配平)首先请补全方程式并配平
您最近一年使用:0次
名校
解题方法
7 . 下列方程式与所给事实不相符 的是
A. 通过灼热铁粉: 通过灼热铁粉: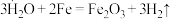 |
B.用 作抗胃酸药: 作抗胃酸药: |
C. 与 与 反应: 反应: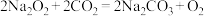 |
D. 通入酸性 通入酸性 溶液中: 溶液中: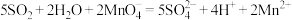 |
您最近一年使用:0次
2023-11-25更新
|
467次组卷
|
3卷引用:湖南省邵东市第三中学2023-2024学年高一上学期第三次月考化学试题
湖南省邵东市第三中学2023-2024学年高一上学期第三次月考化学试题北京市通州区2023-2024学年高三上学期期中质量检测化学试题(已下线)题型03 离子方程式正误判断 离子共存、检验和推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
8 . 氧化还原反应在日常生活和工业生产中有重要应用。
I. 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: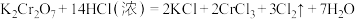 。
。
(1)该反应中被氧化的元素是_______ ,还原产物是_______ 。
(2)该反应中氧化剂与还原剂的个数比为_______ 。
(3)生成标准状况下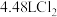 ,转移的电子个数为
,转移的电子个数为_______ (用 表示)。
表示)。
II.阅读下面一段材料并回答问题。
(4)K2FeO4中铁元素的化合价为_______ 。
(5)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:_______ 。
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
I.
 是火柴工业用作制造火柴头的原料之一。已知反应:
是火柴工业用作制造火柴头的原料之一。已知反应: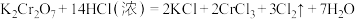 。
。(1)该反应中被氧化的元素是
(2)该反应中氧化剂与还原剂的个数比为
(3)生成标准状况下
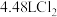 ,转移的电子个数为
,转移的电子个数为 表示)。
表示)。II.阅读下面一段材料并回答问题。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准 |
(5)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(6)将K2FeO4与水反应的化学方程式补充完整并配平:
_______K2FeO4+_______H2O=_______FeOH3(胶体)+_______+_______KOH
您最近一年使用:0次
名校
解题方法
9 . 国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)发电玻璃被誉为“挂在墙上的油田”。一种以镉废渣(含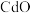 及少量
及少量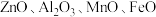 杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
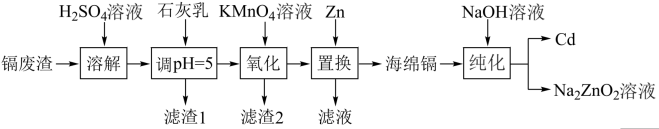
已知:部分金属阳离子以氢氧化物形式沉淀时溶液的 如下表所示:
如下表所示:
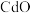 及少量
及少量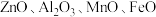 杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
已知:部分金属阳离子以氢氧化物形式沉淀时溶液的
 如下表所示:
如下表所示:| 金属阳离子 |  |  |  |
开始沉淀时的 | 2.7 | 6.3 | 3.4 |
完全沉淀时的 | 3.2 | 8.3 | 5.0 |
A.滤渣1的主要成分是 |
B. 置换之后的滤液主要成分是 置换之后的滤液主要成分是 和 和 |
C.“纯化”过程中发生的反应为 |
| D.该工艺用到的主要分离操作是过滤 |
您最近一年使用:0次
2023-11-23更新
|
573次组卷
|
4卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 为了探究Fe3+、Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如图所示。请回答:
(1)写出AgNO3的电离方程式:___________ 。
(2)实验Ⅰ、Ⅱ的现象和结论如表:

①实验Ⅰ的现象___________ 。②实验Ⅱ的结论___________ 。
③写出实验Ⅱ中发生反应的离子方程式:___________ 。
④写出实验Ⅲ中发生反应的离子方程式:___________ 。
(3)Fe、Cu、CuSO4溶液、AgNO3溶液均能导电,CuSO4溶液、AgNO3溶液能导电的原因是___________ 。
(4)实验Ⅱ中的AgNO3完全反应后,抽出铜丝,洗净后干燥,称重,发现铜丝比反应前增重0.152g,则反应生成的Ag的质量为___________ g。
(1)写出AgNO3的电离方程式:
(2)实验Ⅰ、Ⅱ的现象和结论如表:

| 实验编号 | 实验现象 | 实验结论 |
| Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
| Ⅱ | 溶液变蓝色 | ② |
| Ⅲ | 铜丝溶解,溶液颜色变浅 | 氧化性:Fe3+>Cu2+ |
③写出实验Ⅱ中发生反应的离子方程式:
④写出实验Ⅲ中发生反应的离子方程式:
(3)Fe、Cu、CuSO4溶液、AgNO3溶液均能导电,CuSO4溶液、AgNO3溶液能导电的原因是
(4)实验Ⅱ中的AgNO3完全反应后,抽出铜丝,洗净后干燥,称重,发现铜丝比反应前增重0.152g,则反应生成的Ag的质量为
您最近一年使用:0次



