名校
1 . 在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是| A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 |
| B.该反应在任何条件下都能自发进行 |
| C.再加入一定量氨基甲酸铵,可加快反应速率 |
| D.保持温度不变,压缩体积,达到新的平衡时,NH3的浓度不变 |
您最近一年使用:0次
2017-08-30更新
|
1108次组卷
|
12卷引用:陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题
陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题河南省南阳市第一中学校2023-2024学年高二上学期第一次月考化学试题山东省东明县第一中学2023-2024学年高二上学期10月月考化学试题辽宁省六校协作体2018届高三期初联考化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过模拟(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)山东省2022-2023学年高二上学期学业水平测试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题6-10)福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题
名校
2 . 在一定条件下某体积一定的密闭容器中发生的反应aA(g)+bB(g) xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
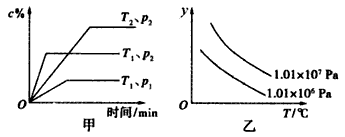
 xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
| A.平衡混合气的密度 |
| B.平衡混合气中B的百分含量 |
| C.平衡混合气的总物质的量 |
| D.平衡混合气的平均相对分子质量 |
您最近一年使用:0次
2017-08-30更新
|
709次组卷
|
9卷引用:内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题
内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题福建省宁化第一中学2021-2022学年高二上学期第一次阶段考试化学试题江西省赣州市教育发展联盟2021-2022学年高二上学期第7次联考化学试题 黑龙江省大庆中学2018届高三上学期开学考试化学试题江西省鹰潭市2020-2021学年高二上学期期末质量检测化学试题辽宁省盘锦市育才学校2020-2021学年高二下学期期初考试化学试题山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题江西省新余市2021-2022学年高二上学期期末检测化学试题
名校
3 . 在一定温度下,2HI(g) H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是
H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是
 H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是
H2(g)+I2(g) △H>0的反应达到平衡,下列条件的改变将使混含气体颜色加深的是| A.降低HI的浓度 | B.升高反应温度 | C.增大容器体积 | D.增大氢气浓度 |
您最近一年使用:0次
2017-08-20更新
|
350次组卷
|
3卷引用:湖北省宜昌市葛洲坝中学2019-2020学年高二10月月考化学试题
名校
4 . 氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________ 。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________ 。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是_________________ ;测得B(X,60)点时N2的转化率为50%,则X=________ 。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________ 。
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g)
 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1③4NO(g)+6H2O(g)
 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式
(二)工业合成氨的原理为:N2(g)+3H2(g)
 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。(1)下列反应条件的控制不能用勒夏特列原理解释的是
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是

(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:
您最近一年使用:0次
2017-04-25更新
|
866次组卷
|
3卷引用:山西省太原市第五中学2020届高三第二次模拟考试(6月) 理科综合化学试题
5 . 在①、②、③容积不等的恒容密闭容器中,均充入0.lmolCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)  CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
下列说法正确的是
 CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示: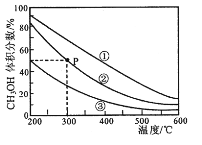
下列说法正确的是
| A.该反应的正反应为放热反应 |
| B.三个容器容积:①>②>③ |
| C.在P点,CO转化率为75% |
| D.在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
您最近一年使用:0次
2017-03-22更新
|
684次组卷
|
5卷引用:江苏省泰州中学2018届高三10月月考化学试题
名校
6 . 已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
 N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
| A.b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深 |
| B.c点与a点相比,n(NO2)减小,混合气体密度增大 |
| C.d 点:v(正)<v(逆) |
D.若在注射器中对反应H2(g)+I2(g)  2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 |
您最近一年使用:0次
2017-02-28更新
|
322次组卷
|
3卷引用:四川省泸县第四中学2019-2020学年高二下学期第一次在线月考化学试题
名校
7 . 下列叙述中正确的是
A.向氨水中不断通入CO2, 随着CO2的增加, 不断变大 不断变大 |
| B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu |
| C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)= 4Fe(OH)3(s) △H>0, △S<0 |
D.将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深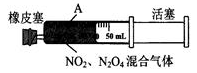 |
您最近一年使用:0次
2017-02-28更新
|
454次组卷
|
3卷引用:湖南省永州市双牌县第二中学2019届高三上学期12月月考化学试题
名校
解题方法
8 . 一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
| A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1 |
| B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 |
| C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10% |
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时 减小 减小 |
您最近一年使用:0次
2017-02-17更新
|
717次组卷
|
7卷引用:【全国百强校】江苏省南通市海安高级中学2018-2019学年高二12月月考(选修)化学试题
9 . 在一定条件下,某可逆反应aA(g)+bB(s)⇌cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是
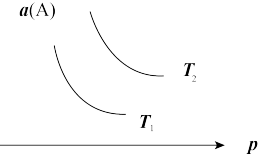

| A.a+b<c |
| B.若T2>T1,则该反应在高温下易自发进行 |
| C.△H>0 |
| D.若T2<T1,则该反应一定不能自发进行 |
您最近一年使用:0次
名校
10 . 已知反应:2NO2(红棕色) N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

 N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是拉伸注射器 |
| B.d点:v(正)>v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
您最近一年使用:0次
2016-12-09更新
|
115次组卷
|
2卷引用:2016届湖南省长沙长郡中学高三下学期第六次月考化学试卷



