1 . 在 ℃,
℃,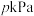 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol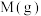 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时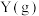 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 ℃,
℃,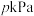 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol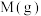 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时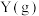 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.随着 的增大, 的增大,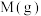 的转化率逐渐增大 的转化率逐渐增大 |
B.e点: |
C.a点时,该反应的平衡常数为 |
D.a点,平衡后再投入1mol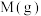 和1mol 和1mol ,达到新平衡时, ,达到新平衡时,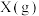 的产率增大 的产率增大 |
您最近半年使用:0次
解题方法
2 . 聚丙烯是生产N95口罩和医用无纺布口罩防护服材料,而丙烯是制造聚丙烯的单体。工业上,生成丙烯的方法有多种。
Ⅰ.以异丙醇为原料制备丙烯。已知:
①
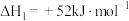 ;
;
②
 ;
;
③
 。
。
(1) 为
为___________  。
。
(2)反应③在___________ (填“较高”“较低”或“任意”)温度下能自发进行。
Ⅱ.近日,中国石油大学(华东)代鹏程副教授课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。有关反应如下:
反应1: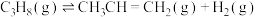

反应2: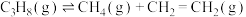
 。
。
(3)向密闭反应器中充入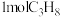 ,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
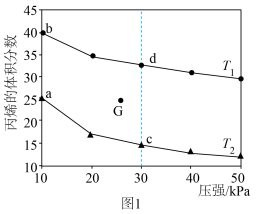
①其他条件相同,增大压强,丙烯体积分数减小的原因是___________ 。
②已知G点为某条件下的平衡状态,若将G点对应反应容器降温同时缩小容器体积使体系压强增大,重新达到平衡状态可能是图中a、b、c、d中的___________ 点。
③下列物理量中,图中c点大于d点的是___________ (填字母)。
A.正反应速率 B.对应温度的平衡常数 C.逆反应速率 D.平均摩尔质量
(4)一定温度下,若向密闭反应器中充入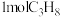 ,发生上述两个反应,达到平衡时,丙烯的体积分数为
,发生上述两个反应,达到平衡时,丙烯的体积分数为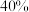 ,丙烯、乙烯体积之比为
,丙烯、乙烯体积之比为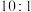 ,丙烷的平衡转化率为
,丙烷的平衡转化率为___________ (用百分数表示,结果保留3位有效数字)。
(5)一定温度下,总压保持为 时,向反应器中充入
时,向反应器中充入 和
和 ,发生上述两个反应。测得丙烷平衡转化率与投料比
,发生上述两个反应。测得丙烷平衡转化率与投料比 的关系如图2所示。
的关系如图2所示。
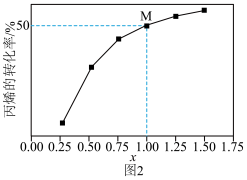
①向反应器充入 的目的是
的目的是___________ 。
②该温度下, 点丙烯的选择性为
点丙烯的选择性为 ,此时反应1的平衡常数
,此时反应1的平衡常数 为
为___________ 。
提示:(i)用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的量分数;(ii)丙烯的选择性
物质的量分数;(ii)丙烯的选择性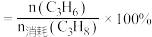 。
。
Ⅰ.以异丙醇为原料制备丙烯。已知:
①

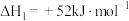 ;
;②

 ;
;③

 。
。(1)
 为
为 。
。(2)反应③在
Ⅱ.近日,中国石油大学(华东)代鹏程副教授课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。有关反应如下:
反应1:
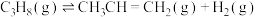

反应2:
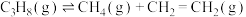
 。
。(3)向密闭反应器中充入
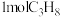 ,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
,发生上述反应1,测得平衡时的丙烯的体积分数与温度、压强的关系如图1所示。
①其他条件相同,增大压强,丙烯体积分数减小的原因是
②已知G点为某条件下的平衡状态,若将G点对应反应容器降温同时缩小容器体积使体系压强增大,重新达到平衡状态可能是图中a、b、c、d中的
③下列物理量中,图中c点大于d点的是
A.正反应速率 B.对应温度的平衡常数 C.逆反应速率 D.平均摩尔质量
(4)一定温度下,若向密闭反应器中充入
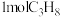 ,发生上述两个反应,达到平衡时,丙烯的体积分数为
,发生上述两个反应,达到平衡时,丙烯的体积分数为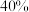 ,丙烯、乙烯体积之比为
,丙烯、乙烯体积之比为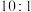 ,丙烷的平衡转化率为
,丙烷的平衡转化率为(5)一定温度下,总压保持为
 时,向反应器中充入
时,向反应器中充入 和
和 ,发生上述两个反应。测得丙烷平衡转化率与投料比
,发生上述两个反应。测得丙烷平衡转化率与投料比 的关系如图2所示。
的关系如图2所示。
①向反应器充入
 的目的是
的目的是②该温度下,
 点丙烯的选择性为
点丙烯的选择性为 ,此时反应1的平衡常数
,此时反应1的平衡常数 为
为提示:(i)用分压计算的平衡常数为
 ,分压
,分压 总压
总压 物质的量分数;(ii)丙烯的选择性
物质的量分数;(ii)丙烯的选择性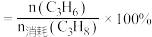 。
。
您最近半年使用:0次
3 . 利用页岩气中丰富的丙烷制丙烯已成为化工原料丙烯生产的重要渠道。
Ⅰ.丙烷直接脱氢法: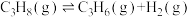
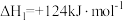
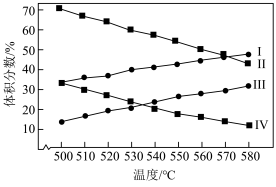
总压分别为100kPa、10kPa时发生该反应,平衡体系中 和
和 的体积分数随温度、压强的变化如下图。
的体积分数随温度、压强的变化如下图。
(1)丙烷直接脱氢反应的化学平衡常数表达式为
_________ 。
(2)总压由10kPa变为100kPa时,化学平衡常数_________ (填“变大”“变小”或“不变”)。
(3)图中,曲线Ⅰ、Ⅲ表示 的体积分数随温度的变化,判断依据是
的体积分数随温度的变化,判断依据是_________ 。
(4)图中,表示100kPa时 的体积分数随温度变化的曲线是
的体积分数随温度变化的曲线是___________ (填“Ⅱ”或“Ⅳ”)。
Ⅱ.丙烷氧化脱氢法:


我国科学家制备了一种新型高效催化剂用于丙烷氧化脱氢。在催化剂作用下,相同时间内,不同温度下的转化率和C3H6的产率如下:
(5)表中,C3H8的转化率随温度升高而上升的原因是_________ (答出1点即可)。
(6)已知:C3H6选择性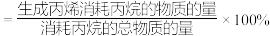 。随着温度升高,C3H6的选择性
。随着温度升高,C3H6的选择性_________ (填“升高”“降低”或“不变”)。
Ⅰ.丙烷直接脱氢法:
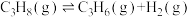
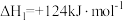
总压分别为100kPa、10kPa时发生该反应,平衡体系中
 和
和 的体积分数随温度、压强的变化如下图。
的体积分数随温度、压强的变化如下图。
(1)丙烷直接脱氢反应的化学平衡常数表达式为

(2)总压由10kPa变为100kPa时,化学平衡常数
(3)图中,曲线Ⅰ、Ⅲ表示
 的体积分数随温度的变化,判断依据是
的体积分数随温度的变化,判断依据是(4)图中,表示100kPa时
 的体积分数随温度变化的曲线是
的体积分数随温度变化的曲线是Ⅱ.丙烷氧化脱氢法:


我国科学家制备了一种新型高效催化剂用于丙烷氧化脱氢。在催化剂作用下,相同时间内,不同温度下的转化率和C3H6的产率如下:
| 反应温度/℃ | 465 | 480 | 495 | 510 |
| C3H8的转化率/% | 5.5 | 12.1 | 17.3 | 28.4 |
| C3H6的产率/% | 4.7 | 9.5 | 12.8 | 18.5 |
(5)表中,C3H8的转化率随温度升高而上升的原因是
(6)已知:C3H6选择性
 。随着温度升高,C3H6的选择性
。随着温度升高,C3H6的选择性
您最近半年使用:0次
名校
4 . T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示。下列分析正确的是
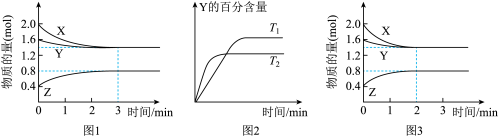

A.容器中发生的反应可表示为:2X(g)+Y(g) 2Z(g) 2Z(g) |
B.0~3 min内, (X)=0.2 mol•L-1•min-1 (X)=0.2 mol•L-1•min-1 |
C.其他条件不变升高温度, 正、 正、 逆都增大,且重新平衡前 逆都增大,且重新平衡前 正> 正> 逆 逆 |
| D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强 |
您最近半年使用:0次
名校
5 . 下图(左)表示1-甲基萘(1-MN)加氢饱和反应网络,四个加氢反应均为放热反应(用反应1、2、3、4表示)。下图(右)表示反应温度(T)对平衡时反应体系中有机化合物物质的量分数(x/%)的影响(6MPa,1-MN和 体积比为1∶5条件下)。下列说法
体积比为1∶5条件下)。下列说法不正确 的是
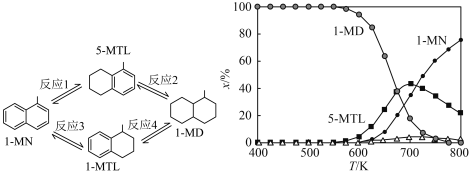
 体积比为1∶5条件下)。下列说法
体积比为1∶5条件下)。下列说法
| A.800K反应2和反应4生成1-MD的程度很小 |
| B.600K到800K,反应1的平衡常数逐渐减小 |
| C.700K反应1的平衡常数小于反应3的平衡常数 |
| D.600K到650K,反应2中5-MTL增加的量大于反应1中5-MTL减少的量 |
您最近半年使用:0次
6 . 可逆反应A(?)+aB(g) C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
 C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
C(g)+2D(g)(a为正整数) ΔH。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是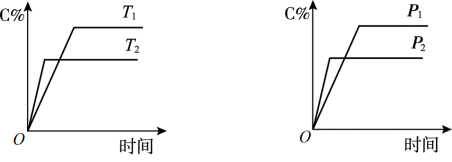
| A.T1>T2、p1>p2 | B.a不可能大于3 |
| C.该反应的ΔH>0 | D.反应过程中,始终有v(C)=2v(D) |
您最近半年使用:0次
名校
解题方法
7 .  温度下,向
温度下,向 恒容密闭容器中加入
恒容密闭容器中加入 固体,发生反应
固体,发生反应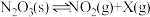 (未配平),反应过程如图,下列说法正确的是
(未配平),反应过程如图,下列说法正确的是
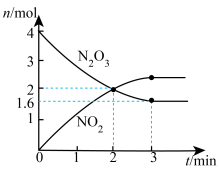
A.X可能为 |
B.第 时逆反应速率大于第 时逆反应速率大于第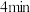 时逆反应速率 时逆反应速率 |
C. 用 用 表示的反应速率为 表示的反应速率为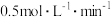 |
D.第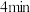 时,保持T和V不变,向容器中再加入 时,保持T和V不变,向容器中再加入 ,正反应速率加快 ,正反应速率加快 |
您最近半年使用:0次
8 . 密闭容器中进行的可逆反应:

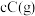 在不同温度(
在不同温度( 和
和 )及压强(
)及压强( 和
和 )下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是
)下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是



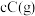 在不同温度(
在不同温度( 和
和 )及压强(
)及压强( 和
和 )下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是
)下,混合气体中B的质量分数W(B)与反应时间(t)的关系如图所示。下列判断正确的是
A. , ,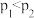 , ,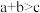 ,正反应为吸热反应 ,正反应为吸热反应 |
B.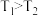 ,P1< P2, ,P1< P2,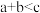 ,正反应为放热反应 ,正反应为放热反应 |
C.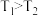 , ,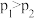 , ,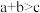 ,正反应为放热反应 ,正反应为放热反应 |
D.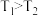 , ,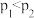 , ,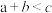 ,正反应为吸热反应 ,正反应为吸热反应 |
您最近半年使用:0次
名校
9 . 羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业。利用工厂废气中的H2S和CO反应可以合成COS,回答下列问题:
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g) H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
④CO(g)+H2S(g) COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3
则ΔH3=_______ kJ•mol-1。
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是_______ (填“甲”或“乙”)。
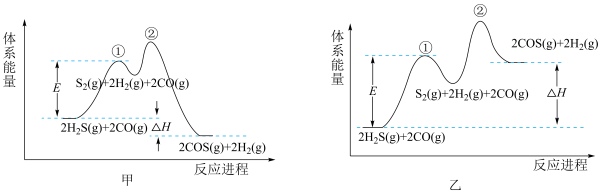
关于该反应的下列叙述正确的是_______ (填标号)。
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g) COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为______ ,COS的体积分数为______ 。在240℃下,要同时提高CO和H2S的转化率,可采取的措施是______ 。
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是______ ,判断的理由是_______ 。
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1④CO(g)+H2S(g)
 COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3则ΔH3=
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是

关于该反应的下列叙述正确的是
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g)
 COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是
您最近半年使用:0次
2024-03-20更新
|
211次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学
解题方法
10 . 在容积不变的密闭容器中,一定量的 与
与 发生反应:
发生反应: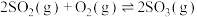 。温度分别为
。温度分别为 和
和 时,
时,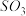 的体积分数随时间的变化如图所示。下列判断错误的是
的体积分数随时间的变化如图所示。下列判断错误的是
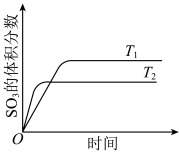
 与
与 发生反应:
发生反应: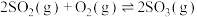 。温度分别为
。温度分别为 和
和 时,
时,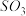 的体积分数随时间的变化如图所示。下列判断错误的是
的体积分数随时间的变化如图所示。下列判断错误的是
A.反应温度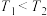 |
B.该反应的 |
C.若 和 和 时的平衡常数分别为 时的平衡常数分别为 和 和 ,则 ,则 |
D.若 和 和 时使用相同的催化剂,其催化效果可能不同 时使用相同的催化剂,其催化效果可能不同 |
您最近半年使用:0次



