解题方法
1 . 煤的气化、液化和焦化是煤综合利用的主要方法。利用这些加工手段可以从煤中获得多种化工原料,用于进一步的化工生产。
(1)煤的气化发生的主要反应是: 。
。
已知: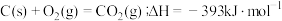
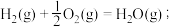

CO(g)+ O2(g)=CO2(g);
O2(g)=CO2(g);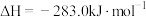
煤气化时发生主要反应的热化学方程式是___________ 。
(2)用煤气化后得到的 合成氨:
合成氨: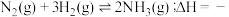
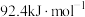 。一定温度下,在容积为
。一定温度下,在容积为 的密闭容器中充入
的密闭容器中充入 和
和 充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。
充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。
(3)如图是合成氨反应平衡混合气中 的体积分数随温度或压强变化的曲线,图中
的体积分数随温度或压强变化的曲线,图中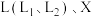 分别代表温度或压强。其中X代表的是
分别代表温度或压强。其中X代表的是___________ (填“温度”或“压强”);判断
___________  (填“>”或“<”),理由是
(填“>”或“<”),理由是___________ 。
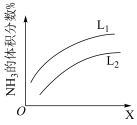
(4)某温度时合成甲醇的反应
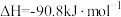 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:
①前2min的反应速率
___________ 。
②该温度下的平衡常数___________ 。(可用分数表示)
(1)煤的气化发生的主要反应是:
 。
。已知:
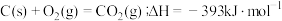
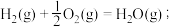

CO(g)+
 O2(g)=CO2(g);
O2(g)=CO2(g);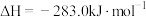
煤气化时发生主要反应的热化学方程式是
(2)用煤气化后得到的
 合成氨:
合成氨: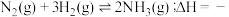
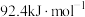 。一定温度下,在容积为
。一定温度下,在容积为 的密闭容器中充入
的密闭容器中充入 和
和 充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。
充分反应,下列条件能判断该反应达到平衡状态的是___________(填字母)。A. 和 和 的物质的量之比不变 的物质的量之比不变 | B.容器内压强不变 |
C. 键断裂的同时,有 键断裂的同时,有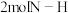 键形成 键形成 | D.氨气的体积分数不变 |
(3)如图是合成氨反应平衡混合气中
 的体积分数随温度或压强变化的曲线,图中
的体积分数随温度或压强变化的曲线,图中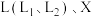 分别代表温度或压强。其中X代表的是
分别代表温度或压强。其中X代表的是
 (填“>”或“<”),理由是
(填“>”或“<”),理由是
(4)某温度时合成甲醇的反应

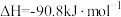 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示: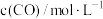 | 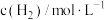 |  | |
| 0 | 1.0 | 1.8 | 0 |
| 2min | 0.5 | 0.5 | |
| 4min | 0.4 | 0.6 | 0.6 |
| 6min | 0.4 | 0.6 | 0.6 |

②该温度下的平衡常数
您最近半年使用:0次
解题方法
2 .  是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。
(1)在催化剂作用下,可用 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:
则
___________  。
。
(2)在刚性密闭容器中, 平衡时的体积分数随投料比
平衡时的体积分数随投料比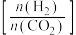 的变化如图所示:
的变化如图所示:
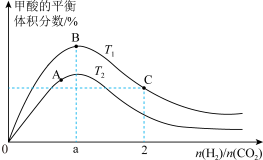
①图中 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②A、B、C三点 的平衡转化率
的平衡转化率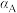 、
、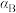 、
、 ,由大到小的顺序为
,由大到小的顺序为___________ 。
(3) 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中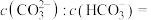
___________ 。(室温下,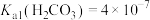 ,
,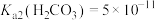 )。
)。
(4)二氧化碳的重整利用的另一方式为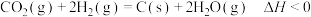 。
。
在250℃时,向体积为2L恒容密闭容器中通入 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
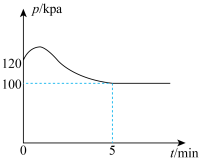
①为提高平衡时 的转化率,反应条件应选择
的转化率,反应条件应选择___________ (填标号)。
A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数
___________ 。
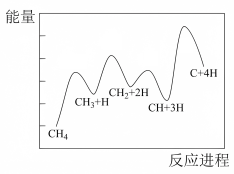
(5)一定条件下, 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第___________ 步反应。
 是目前大气中含量最高的一种温室气体。
是目前大气中含量最高的一种温室气体。 的捕获与重整是
的捕获与重整是 利用的研究热点。
利用的研究热点。(1)在催化剂作用下,可用
 与
与 反应制取甲酸。已知:
反应制取甲酸。已知:| 共价键 |  |  |  |  |  |
键能 | 799 | 343 | 436 | 463 | 413 |

 。
。(2)在刚性密闭容器中,
 平衡时的体积分数随投料比
平衡时的体积分数随投料比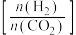 的变化如图所示:
的变化如图所示:
①图中
 、
、 表示不同的反应温度,判断
表示不同的反应温度,判断
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②A、B、C三点
 的平衡转化率
的平衡转化率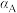 、
、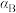 、
、 ,由大到小的顺序为
,由大到小的顺序为(3)
 可以被
可以被 溶液捕获,当溶液
溶液捕获,当溶液 时,所得溶液中
时,所得溶液中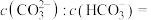
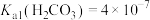 ,
,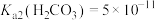 )。
)。(4)二氧化碳的重整利用的另一方式为
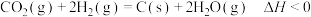 。
。在250℃时,向体积为2L恒容密闭容器中通入
 和
和 发生该反应,测得容器内气压变化如图所示。
发生该反应,测得容器内气压变化如图所示。
①为提高平衡时
 的转化率,反应条件应选择
的转化率,反应条件应选择A.高压 B.低压 C.低温 D.高温
②该温度下的平衡常数

(5)一定条件下,
 分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
分解形成碳的反应历程如图所示分4步完成,其中决定反应速率的是第
您最近半年使用:0次
解题方法
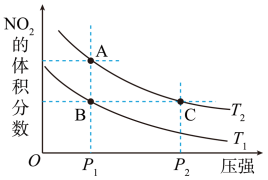
3 . 反应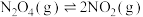
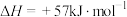 ,在温度为
,在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。下列说法正确的是
的体积分数随压强变化曲线如图所示。下列说法正确的是
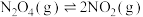
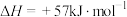 ,在温度为
,在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。下列说法正确的是
的体积分数随压强变化曲线如图所示。下列说法正确的是
A.由图可知,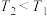 |
B.从A点变到 点,平衡逆移,气体的颜色: 点,平衡逆移,气体的颜色: 深, 深, 浅 浅 |
| C.该反应在低温下能自发进行 |
D. 、 、 两点气体的平均相对分子质量: 两点气体的平均相对分子质量: |
您最近半年使用:0次
解题方法
4 . 氨是重要的化工原料,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)二十世纪初,工业以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
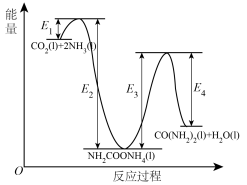
①反应a为反应_____ (填“放热”或“吸热”)。
②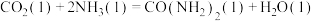

_____ kJ/mol(用含“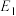 、
、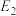 、
、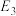 、
、 ”的代数式表示)。
”的代数式表示)。
(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
(i)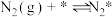
(ii)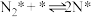
(iii)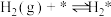
(iv)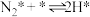
(v)
……
(…)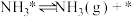
实际生产中, 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:
①_____ ;②_____ 。
(3)若在不同压强下,以投料比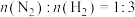 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: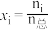 )
)
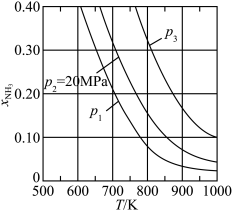
①图中压强由小到大的顺序为_____ 。
②当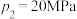 、
、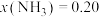 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=_____ (保留到小数点后一位)。
③某温度下,在1L的密闭容器中充入 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得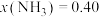 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为_____ 。
(1)二十世纪初,工业以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
①反应a为反应
②
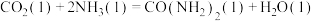

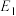 、
、 、
、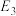 、
、 ”的代数式表示)。
”的代数式表示)。(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位,
 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。(i)
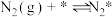
(ii)
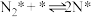
(iii)
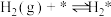
(iv)
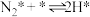
(v)

……
(…)
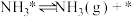
实际生产中,
 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:①
(3)若在不同压强下,以投料比
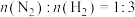 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: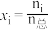 )
)
①图中压强由小到大的顺序为
②当
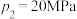 、
、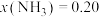 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=③某温度下,在1L的密闭容器中充入
 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得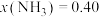 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为
您最近半年使用:0次
名校
解题方法
5 . Ⅰ.近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知: 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: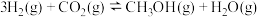
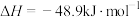 。
。
①总压分别为100kPa、10kPa 时发生该反应,平衡体系中CO2和CH3OH的物质的量分数随温度变化关系如图所示。

100 kPa时,CO2和CH3OH的物质的量分数随温度变化关系的曲线分别是____ 、____ 。
②某温度下,在刚性容器中充入n(H2):n(CO2)=3:1,起始压强为12 kPa,平衡时总压为8 kPa,该反应的平衡常数Kp=_____ kPa (用分压代替平衡浓度,分压=总压×物质的量分数)。
(2)为提高 的产率,理论上应采用的条件是_____(填序号)。
的产率,理论上应采用的条件是_____(填序号)。
(3)催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为______ (填实验编号)。
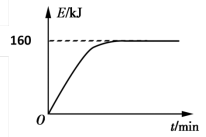
(4)CO2也能与CH4制备合成气,反应原理是CH4(g)+CO2(g) 2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为______ %(保留一位小数)。
Ⅱ.甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。已知相关物质的燃烧热如下表:
(5)写出表示乙烯燃烧热的热化学方程式:________ 。
(6)甲烷脱氢反应2CH4(g) ⇌ C2H4(g)+2H2(g) △H=_____
Ⅲ.温度为T1时,在一个容积均为1L的密闭容器中仅发生反应: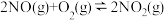
 。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
(7)温度为T1时,
______ (填数据);当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m___ n(填“>”、“<”或“=”)
(8)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数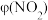 随
随 的变化如图所示,当
的变化如图所示,当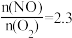 时,达到平衡时
时,达到平衡时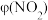 可能是D、E、F三点中的
可能是D、E、F三点中的____ 。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: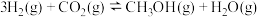
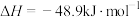 。
。①总压分别为100kPa、10kPa 时发生该反应,平衡体系中CO2和CH3OH的物质的量分数随温度变化关系如图所示。

100 kPa时,CO2和CH3OH的物质的量分数随温度变化关系的曲线分别是
②某温度下,在刚性容器中充入n(H2):n(CO2)=3:1,起始压强为12 kPa,平衡时总压为8 kPa,该反应的平衡常数Kp=
(2)为提高
 的产率,理论上应采用的条件是_____(填序号)。
的产率,理论上应采用的条件是_____(填序号)。| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
| 实验编号 | 温度/K | 催化剂 |  的转化率/% 的转化率/% | 甲醇的选择性/% |
| A | 543 | 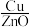 纳米棒 纳米棒 | 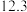 |  |
| B | 543 | 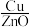 纳米片 纳米片 | 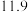 | 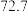 |
| C | 553 | 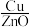 纳米棒 纳米棒 | 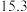 | 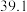 |
| D | 553 | 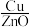 纳米片 纳米片 | 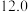 |  |
 生产甲醇的最优条件为
生产甲醇的最优条件为(4)CO2也能与CH4制备合成气,反应原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
Ⅱ.甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。已知相关物质的燃烧热如下表:
| 物质 | 氢气 | 甲烷 | 乙烯 |
| 燃烧热(kJ∙mol−1) | 286 | 890 | 1411 |
(6)甲烷脱氢反应2CH4(g) ⇌ C2H4(g)+2H2(g) △H=
Ⅲ.温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:
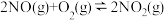
 。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。| 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
| c(NO) | c(O2) | c(NO2) | c(O2) |
| 0.6 | 0.3 | 0 | 0.2 |

(8)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数
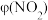 随
随 的变化如图所示,当
的变化如图所示,当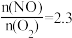 时,达到平衡时
时,达到平衡时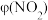 可能是D、E、F三点中的
可能是D、E、F三点中的
您最近半年使用:0次
名校
6 . 下列关于化学反应图像的说法错误的是

A.图1可表示反应2NO2(g) N2O4(g)在等温、等压条件下平衡后t时刻充入NO2时反应速率随时间的变化图像 N2O4(g)在等温、等压条件下平衡后t时刻充入NO2时反应速率随时间的变化图像 |
B.图2可表示在一定温度下将0.5 mol CO和0.5 mol H2充入体积为2 L的密闭容器中发生反应CO(g)+2H2(g) CH3OH(g)时,CO体积分数随时间的变化图像 CH3OH(g)时,CO体积分数随时间的变化图像 |
C.图3可表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,且温度:T1>T2 2SO3(g) ΔH<0,且温度:T1>T2 |
D.图4可表示反应mA(g)+nB(g) pC(s)+qD(g) ΔH>0,且m+n>p+q pC(s)+qD(g) ΔH>0,且m+n>p+q |
您最近半年使用:0次
名校
7 . 下列图示与对应的叙述相符的是


A.图甲表示某可逆反应的反应速率随时间的变化,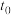 时刻改变的条件一定是使用催化剂 时刻改变的条件一定是使用催化剂 |
B.图乙表示平衡 在 在 时迅速将体积缩小后 时迅速将体积缩小后 的变化 的变化 |
C.图丙表示在相同的密闭容器中不同温度下的反应,该反应的 |
D.图丁表示反应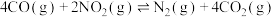 ,在其他条件不变的情况下改变起始 ,在其他条件不变的情况下改变起始 的物质的量,平衡时 的物质的量,平衡时 的体积分数变化情况,由图可知b点 的体积分数变化情况,由图可知b点 的转化率最大 的转化率最大 |
您最近半年使用:0次
2024-01-30更新
|
118次组卷
|
2卷引用:河南省部分重点中学2023-2024学年高二上学期期末联考 化学试题
名校
解题方法
8 . 工业生产硫酸的一步重要反应是
 ,如果该反应在容积不变的密闭容器中进行,图中表示当其他条件不变时,改变某一条件对上述反应的影响,其中结论正确的是
,如果该反应在容积不变的密闭容器中进行,图中表示当其他条件不变时,改变某一条件对上述反应的影响,其中结论正确的是

 ,如果该反应在容积不变的密闭容器中进行,图中表示当其他条件不变时,改变某一条件对上述反应的影响,其中结论正确的是
,如果该反应在容积不变的密闭容器中进行,图中表示当其他条件不变时,改变某一条件对上述反应的影响,其中结论正确的是
| A.图Ⅰ表示催化剂对化学平衡的影响,且甲使用了催化剂 |
| B.图Ⅰ表示温度对化学平衡的影响,且乙温度低 |
C.图Ⅱ表示 平衡转化率与温度及压强的关系,可以判断 平衡转化率与温度及压强的关系,可以判断 |
D.图Ⅲ表示 时刻升高温度或增大压强对反应速率的影响 时刻升高温度或增大压强对反应速率的影响 |
您最近半年使用:0次
名校
解题方法
9 . 磷资源流失到水环境中会造成水体富营养化。已知: 基磁性纳米复合材料,由
基磁性纳米复合材料,由 和纳米
和纳米 经过超声分散制得。能通过纳米
经过超声分散制得。能通过纳米 物理吸附和
物理吸附和 溶出后通过化学反应等去除水体磷。已知:纳米
溶出后通过化学反应等去除水体磷。已知:纳米 颗粒表面带正电荷;部分物质的溶解性如下表。
颗粒表面带正电荷;部分物质的溶解性如下表。
(1)制备复合材料所需的纳米 :一定条件下,先将
:一定条件下,先将 和
和 晶体配制成混合溶液,再与氨水反应可制得纳米
晶体配制成混合溶液,再与氨水反应可制得纳米 ,实验装置如下:
,实验装置如下:
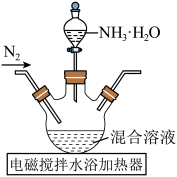
①氨水缓慢滴入,开始一段时间内未出现浑浊,原因是___________ 。
②制备纳米 需控温在50~60°℃之间,写出该反应的化学方程式:
需控温在50~60°℃之间,写出该反应的化学方程式:___________ 。
③配制混合溶液时按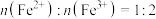 进行投料:实验中需不断通入
进行投料:实验中需不断通入 。通
。通 的目的是
的目的是___________ 。
(2)研究不同pH下向含磷(V)废水中加入 纳米复合材料的除磷效果:
纳米复合材料的除磷效果:
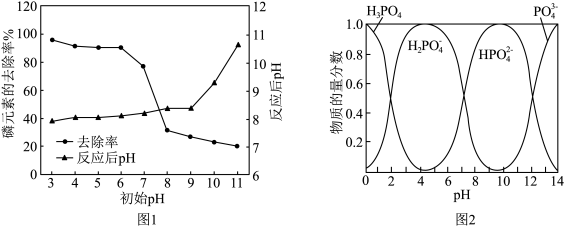
①从图1中可以看出初始pH为3~6时,磷的去除率较高且反应后pH均有一定的上升,反应过程中无气体生成。结合图2,写出对应的离子方程式:___________ 。
②当初始pH为9~10时,磷的去除率明显小于初始pH为3~6的去除率,是因为___________ 。
(3)除磷后续处理
除磷回收得到的磷矿物 ,可进一步转化为
,可进一步转化为 ,作为钾磷复合肥使用。设计由
,作为钾磷复合肥使用。设计由 浆料制备
浆料制备 晶体的实验方案:向含
晶体的实验方案:向含 的浆料中
的浆料中___________ ,干燥。[已知: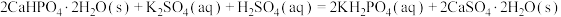 ;室温下从
;室温下从 饱和溶液中可结晶析出
饱和溶液中可结晶析出 晶体;实验中
晶体;实验中须选用 的试剂: 溶液、
溶液、 溶液,pH试纸,无水乙醇]
溶液,pH试纸,无水乙醇]
 基磁性纳米复合材料,由
基磁性纳米复合材料,由 和纳米
和纳米 经过超声分散制得。能通过纳米
经过超声分散制得。能通过纳米 物理吸附和
物理吸附和 溶出后通过化学反应等去除水体磷。已知:纳米
溶出后通过化学反应等去除水体磷。已知:纳米 颗粒表面带正电荷;部分物质的溶解性如下表。
颗粒表面带正电荷;部分物质的溶解性如下表。| 物质 |  |  |  |  |
| 溶解性 | 难溶 | 微溶 | 可溶 | 易溶 |
(1)制备复合材料所需的纳米
 :一定条件下,先将
:一定条件下,先将 和
和 晶体配制成混合溶液,再与氨水反应可制得纳米
晶体配制成混合溶液,再与氨水反应可制得纳米 ,实验装置如下:
,实验装置如下:
①氨水缓慢滴入,开始一段时间内未出现浑浊,原因是
②制备纳米
 需控温在50~60°℃之间,写出该反应的化学方程式:
需控温在50~60°℃之间,写出该反应的化学方程式:③配制混合溶液时按
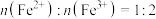 进行投料:实验中需不断通入
进行投料:实验中需不断通入 。通
。通 的目的是
的目的是(2)研究不同pH下向含磷(V)废水中加入
 纳米复合材料的除磷效果:
纳米复合材料的除磷效果:
①从图1中可以看出初始pH为3~6时,磷的去除率较高且反应后pH均有一定的上升,反应过程中无气体生成。结合图2,写出对应的离子方程式:
②当初始pH为9~10时,磷的去除率明显小于初始pH为3~6的去除率,是因为
(3)除磷后续处理
除磷回收得到的磷矿物
 ,可进一步转化为
,可进一步转化为 ,作为钾磷复合肥使用。设计由
,作为钾磷复合肥使用。设计由 浆料制备
浆料制备 晶体的实验方案:向含
晶体的实验方案:向含 的浆料中
的浆料中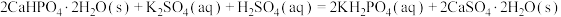 ;室温下从
;室温下从 饱和溶液中可结晶析出
饱和溶液中可结晶析出 晶体;实验中
晶体;实验中 溶液、
溶液、 溶液,pH试纸,无水乙醇]
溶液,pH试纸,无水乙醇]
您最近半年使用:0次
解题方法
10 . 对于反应N2O4(g) 2NO2(g),在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的每个点为对应压强下的平衡点),下列说法正确的是
2NO2(g),在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的每个点为对应压强下的平衡点),下列说法正确的是
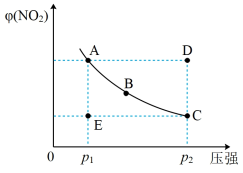
 2NO2(g),在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的每个点为对应压强下的平衡点),下列说法正确的是
2NO2(g),在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的每个点为对应压强下的平衡点),下列说法正确的是
| A.A、C两点的正反应速率的关系为A>C |
| B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E |
| C.维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x>y |
| D.使E状态从水平方向到达C状态,再沿平衡曲线到达A状态,从理论上来讲可选用的条件是从p1缓慢加压至p2,再由p2无限突然降压至p1 |
您最近半年使用:0次



