名校
1 . 将浓盐酸加到NaCl饱和溶液中,会析出NaCl晶体,对这种现象正确的解释是
| A.由于c平(Cl-)增加,使溶液中c平(Na+)·c平(Cl-)>Ksp(NaCl),故产生NaCl晶体 |
| B.HCl是强酸,所以它能使NaCl沉淀出来 |
| C.由于c平(Cl-)增加,使NaCl的溶解平衡向析出NaCl的方向移动,故有NaCl沉淀析出 |
| D.酸的存在,降低了盐的溶解度 |
您最近一年使用:0次
2023-08-26更新
|
464次组卷
|
4卷引用:江西省宜丰中学2023-2024学年高三上学期9月月考化学试题
名校
2 . 下列有关实验操作、现象和解释或结论都正确的是
| 选 项 | 操作 | 现象 | 解释或结论 |
| A | 在 KSCN 与 FeCl3的混合液中再加入 KCl 固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| B | 常温下, 向等体积、 等浓度的NaHCO3和CH3COONa 溶液中分别滴加 2 滴酚酞 | 两份 溶液 均变红 ,NaHCO3溶液红色更深 | 常 温 下 的 水 解 平 衡 常 数 :Kh(CH3COO-)>Kh(HCO3-) |
| C | 向重铬酸钾溶液中加水 | 溶液颜色变浅 | 增加反应物H2O的用量,平衡  +H2O +H2O 2 2 +2H+ +2H+向右移动 |
| D |  | 先生成白色沉淀,随后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-22更新
|
154次组卷
|
2卷引用:江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题
名校
解题方法
3 . 利用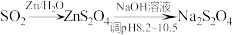 转化制取连二亚硫酸钠(
转化制取连二亚硫酸钠( )的装置如图。下列说法不正确的是
)的装置如图。下列说法不正确的是
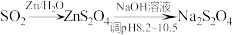 转化制取连二亚硫酸钠(
转化制取连二亚硫酸钠( )的装置如图。下列说法不正确的是
)的装置如图。下列说法不正确的是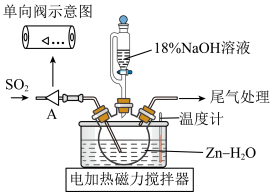
| A.单向阀的作用是防倒吸 |
B.先通入 至悬浊液变澄清,再打开滴液漏斗旋塞 至悬浊液变澄清,再打开滴液漏斗旋塞 |
C.NaOH溶液不宜加入过多的原因是防止 水解 水解 |
| D.上述反应液经过滤,在冷却搅拌下加入一定量NaCl的作用是提高产率 |
您最近一年使用:0次
2023-08-14更新
|
809次组卷
|
3卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
4 . 下列各实验的操作、现象及所得出的结论都正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 氯的非金属性比硅强 |
| B | 向2%稀氨水中滴加2%硝酸银溶液 | 产生白色沉淀,后消失 | 现配现制银氨溶液 |
| C | 玻璃棒蘸取少量某溶液进行焰色试验 | 火焰呈黄色 | 肯定有钠元素 |
| D | 向试管中加入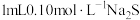 溶液和2滴 溶液和2滴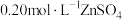 溶液,再滴加2滴 溶液,再滴加2滴 溶液 溶液 | 先产生白色沉淀,后产生黑色沉淀 | 无法比较ZnS、CuS溶度积常数 大小 大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-11更新
|
384次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
5 . 下列“实验现象”和“结论”的因果关系有错误的是。
| 选项 | 操作 | 现象 | 结论 |
| A | 相同温度下,测定等浓度的 和 和 溶液的pH 溶液的pH | 前者pH比后者大 | 非金属性:S>C |
| B | 火柴梗上滴少量的浓硫酸 | 火柴梗变黑 | 浓硫酸具有强氧化性 |
| C | 将20℃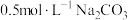 溶液加热到60℃,用pH传感器测定pH 溶液加热到60℃,用pH传感器测定pH | 溶液的pH逐渐减小 |  改变与水解平衡移动共同作用的结果 改变与水解平衡移动共同作用的结果 |
| D | 取一支试管装入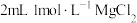 溶液,先滴加 溶液,先滴加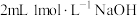 溶液,再滴加几滴 溶液,再滴加几滴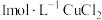 溶液 溶液 | 先生成白色沉淀,后沉淀变为蓝色 | 溶度积: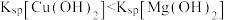 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-09更新
|
106次组卷
|
2卷引用:江西省赣州市全南中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
6 . 下列实验操作和实验现象所对应的实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 把分别盛有NaCl溶液和 胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体 胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体 | 观察到 胶体中有一条光亮的通路,NaCl溶液无明显现象 胶体中有一条光亮的通路,NaCl溶液无明显现象 | 丁达尔效应是胶体和溶液的本质区别 |
B | 向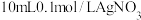 溶液中先滴入5滴0.1mol/LNaCl溶液,再滴入5滴0.1mol/L的KI溶液 溶液中先滴入5滴0.1mol/LNaCl溶液,再滴入5滴0.1mol/L的KI溶液 | 先产生白色沉淀,后产生黄色沉淀 | 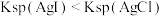 |
C | 向2支试管各加入 的草酸溶液,分别滴加 的草酸溶液,分别滴加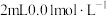 、 、 高锰酸钾溶液 高锰酸钾溶液 | 高锰酸钾溶液褪色并观察褪色时间 | 其他条件不变时,反应物浓度越大,反应速率越快 |
D | 取淀粉溶液于试管中,加入适量稀 后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制 后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制 悬浊液并加热煮沸 悬浊液并加热煮沸 | 生成砖红色沉淀 | 淀粉已水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-08更新
|
129次组卷
|
2卷引用:江西省乐安县第二中学2023-2024学年高三上学期开学考试化学试题
7 .  时,向
时,向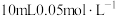 的
的 溶液中通入氨气,测得溶液中的
溶液中通入氨气,测得溶液中的 与
与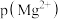 之间的变化曲线如图所示,[已知:
之间的变化曲线如图所示,[已知: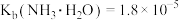 ,
,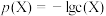 ,忽略反应过程中溶液体积的变化]。下列说法错误为是
,忽略反应过程中溶液体积的变化]。下列说法错误为是
 时,向
时,向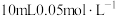 的
的 溶液中通入氨气,测得溶液中的
溶液中通入氨气,测得溶液中的 与
与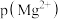 之间的变化曲线如图所示,[已知:
之间的变化曲线如图所示,[已知: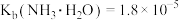 ,
,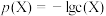 ,忽略反应过程中溶液体积的变化]。下列说法错误为是
,忽略反应过程中溶液体积的变化]。下列说法错误为是
A. 点溶液满足: 点溶液满足: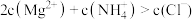 |
B.b点溶液中有 沉淀产生 沉淀产生 |
C. 点溶液中溶质有 点溶液中溶质有 、 、 、 、 |
D.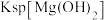 的数量级是 的数量级是 |
您最近一年使用:0次
解题方法
8 . 科学探究是化学学科核心素养之一,下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 相同条件下,分别测量 和 和 '醋酸溶液的导电性,前者的导电性强 '醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B |  溶液蒸干灼烧后得到红色固体 溶液蒸干灼烧后得到红色固体 | 固体成分是 |
| C | 向 和 和 混合溶液中,加入少量 混合溶液中,加入少量 的固体,溶液颜色无变化。 的固体,溶液颜色无变化。 | 改变离子浓度不会引起平衡移动 |
| D | 向盛有2mL0.1mol/L 溶液中滴加2滴0.1mol/L 溶液中滴加2滴0.1mol/L 溶液,得白色沉淀,再向其中加4滴0.1mol/L 溶液,得白色沉淀,再向其中加4滴0.1mol/L 溶液,沉淀转化为黄色 溶液,沉淀转化为黄色 | 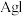 的 的 比 比 的大 的大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
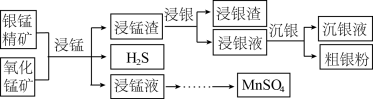
9 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.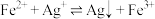 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: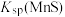
________ (填“>”或“<”)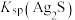 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________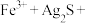 ________
________ ________
________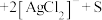
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
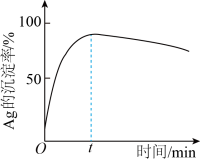
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 和
和________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
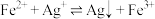 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: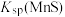
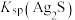 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
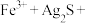 ________
________ ________
________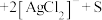
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
594次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题
10 . 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
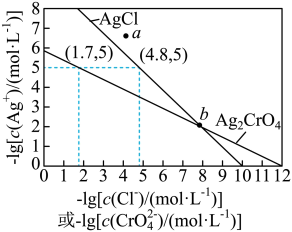
下列说法正确的是

下列说法正确的是
| A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀 |
B.b点时,c(Cl-)=c(CrO ),Ksp(AgCl)=Ksp(Ag2CrO4) ),Ksp(AgCl)=Ksp(Ag2CrO4) |
C.Ag2CrO4+2Cl- 2AgCl+CrO 2AgCl+CrO 的平衡常数K=107.9 的平衡常数K=107.9 |
| D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀 |
您最近一年使用:0次
2023-06-12更新
|
15482次组卷
|
32卷引用:江西省宜丰中学2022-2023学年高二下学期7月期末考试化学试题
江西省宜丰中学2022-2023学年高二下学期7月期末考试化学试题2023年高考全国乙卷化学真题(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国乙卷)(PPT+Word)(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南师范大学附属中学2024届高三摸底考试化学试题 (已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)河南省南阳市第一中学校2023-2024学年高三上学期第一次月考化学试题河南省南阳市南阳一中2023-2024学年高三上学期9月月考化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷重庆市南开中学校2023-2024学年高二上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)10-2023新东方高二上期中考化学(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省娄底市新化县2023-2024学年高二上学期期末考试化学试题北京市第一○一中学2023-2024学年高三下学期开学考试化学试题重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题河北i省石家庄市第二十四中学2023-2024学年高三上学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题天津市红桥区2024届高三一模化学试题河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学广西壮族自治区河池市普通高中2024届高三毕业班下学期模拟测试(二模)化学试题福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题



