解题方法
1 . 五种短周期主族元素的原子半径与常见化合价的关系如图所示,E原子能量最高电子层为 M 层。

回答下列问题:
(1)A元素在元素周期表中的位置为___________ 。
(2) A、D的简单氢化物之间反应生成M,M的电子式为______ 。
(3)B分别与C、E组成的两种化合物之间能发生化合反应同时又是氧化还原反应,写出该反应的化学方程式:___________ 。
(4)在酚酞溶液中加入化合物 EDB粉末,可能观察到的现象是______ 。
(5)A和B 可组成多种化合物,其中一种化合物显红棕色,该化合物是___________ (填化学式)。
(6)向E2C溶液中通入足量D的单质,在反应后的溶液中滴加D的氢化物水溶液和BaCl2溶液,产生白色沉淀。写出E2C溶液和足量D的单质反应的离子方程式:___________ 。

回答下列问题:
(1)A元素在元素周期表中的位置为
(2) A、D的简单氢化物之间反应生成M,M的电子式为
(3)B分别与C、E组成的两种化合物之间能发生化合反应同时又是氧化还原反应,写出该反应的化学方程式:
(4)在酚酞溶液中加入化合物 EDB粉末,可能观察到的现象是
(5)A和B 可组成多种化合物,其中一种化合物显红棕色,该化合物是
(6)向E2C溶液中通入足量D的单质,在反应后的溶液中滴加D的氢化物水溶液和BaCl2溶液,产生白色沉淀。写出E2C溶液和足量D的单质反应的离子方程式:
您最近一年使用:0次
名校
2 . 2023年7月3日,商务部与海关总署发布公告,宣布对镓、锗相关物项实施出口管制。金属镓被称为“电子工业脊梁”,氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:

已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为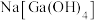 、
、 、
、 。
。
③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度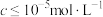 时,可认为已除尽。
时,可认为已除尽。

回答下列问题:
(1)基态Ga原子的核外电子排布式为___________ ,Br在元素周期表中的位置为___________ 。
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出 所发生反应的化学方程式为
所发生反应的化学方程式为___________ 。
(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是___________ (写化学式)。
(4)步骤①和②中通入过量气体A发生反应的离子方程式为___________ 。
(5)常温下,反应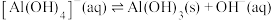 的平衡常数
的平衡常数
___________ 。
(6)以纯镓为原料可制得另一种半导体材料 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为___________ pm(列出计算式即可)。

 、
、 、
、 还有少量
还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:
已知:①镓与铝同族,其化合物性质相似。
②“碱浸”后溶液的主要成分为
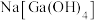 、
、 、
、 。
。③常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度
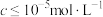 时,可认为已除尽。
时,可认为已除尽。
回答下列问题:
(1)基态Ga原子的核外电子排布式为
(2)已知“焙烧”后铝、镓、硅元素均转化为可溶性钠盐,写出
 所发生反应的化学方程式为
所发生反应的化学方程式为(3)“沉淀”步骤中加入过量稀硫酸至生成的沉淀不再溶解,则滤渣2的主要成分是
(4)步骤①和②中通入过量气体A发生反应的离子方程式为
(5)常温下,反应
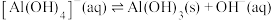 的平衡常数
的平衡常数
(6)以纯镓为原料可制得另一种半导体材料
 ,其晶体结构如图所示,已知晶胞密度为
,其晶体结构如图所示,已知晶胞密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,晶胞边长a为
,晶胞边长a为
您最近一年使用:0次
2024-01-07更新
|
249次组卷
|
2卷引用:2024届湖南省湘东九校联盟高三上学期第一次联考化学试题
3 . W、X、Y、Z为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为3s23p4,X的电离能数据如下表所示。
(1)基态X原子的电子排布式_____ ,X在元素周期表中的位置是_____ ,_____ 区。
(2)用电子式表示WZ的形成过程:_____ 。
(3)下列事实能用元素周期律解释的是_____ (填字母序号)。
a.W可用于制备活泼金属钾
b.Y的气态氢化物的稳定性小于H2O
c.将Z单质通入Na2S溶液中,溶液变浑浊
d.Y的氧化物对应的水化物H2YO3的酸性比H2SiO3强
(4)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为M(OH)n,该水化物中的M-O-H结构有两种断键方式,断M-O键在水中电离出OH-,断O-H键则在水中电离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物的M-O-H结构中,成键原子电负性差异越大,所成化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1,若元素M的电负性数值为2.5,且电负性差异是影响M-O-H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈_____ (填“酸”或“碱”)性,依据是_____ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是_____ (写化学式),结合资料说明理由:_____ 。
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | … |
(2)用电子式表示WZ的形成过程:
(3)下列事实能用元素周期律解释的是
a.W可用于制备活泼金属钾
b.Y的气态氢化物的稳定性小于H2O
c.将Z单质通入Na2S溶液中,溶液变浑浊
d.Y的氧化物对应的水化物H2YO3的酸性比H2SiO3强
(4)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为M(OH)n,该水化物中的M-O-H结构有两种断键方式,断M-O键在水中电离出OH-,断O-H键则在水中电离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物的M-O-H结构中,成键原子电负性差异越大,所成化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1,若元素M的电负性数值为2.5,且电负性差异是影响M-O-H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次
真题
名校
4 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
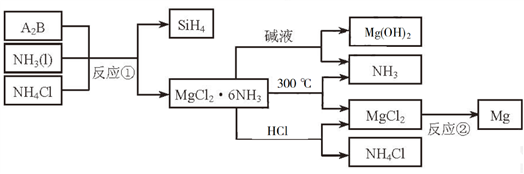
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备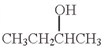 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
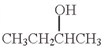 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
3025次组卷
|
13卷引用:2018年全国普通高等学校招生统一考试化学(天津卷)
2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题
名校
5 . 双安妥明的结构简式为 ,可用于降低血液中的胆固醇,该物质合成线路如图224所示:
,可用于降低血液中的胆固醇,该物质合成线路如图224所示:
已知:Ⅰ.C为气体,在标准状况下的密度2.5g/L,且核磁共振氢谱中有两组峰,峰面积之比为3:1.I能发生银镜反应且1mol I(C3H4O)能与2mol H2发生加成反应;K的结构具有对称性。
Ⅱ.
Ⅲ.
试回答下列问题:
(1) 写出双安妥明的分子式___________________ 。
(2) C的结构简式为_____________ ;H的结构简式为 ______________ 。
(3) 反应D→E的反应条件是__________ ,反应I→J的类型是 ______________ 。
(4) 反应“H+K→双安妥明”的化学方程式为_______________________________ 。
(5) M与H的元素组成相同,相对分子质量比H少14,则同时符合下列条件的M的结构共有________ 种。①既可发生银镜反应又可发生水解;
②能与与FeCl3溶液发生显色反应;
③是苯的二元取代物;
(6) 参照上述流程,以丙烯为原料,选用必要的无机试剂合成乳酸(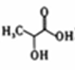 ),写出合成路线
),写出合成路线__________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。)
 ,可用于降低血液中的胆固醇,该物质合成线路如图224所示:
,可用于降低血液中的胆固醇,该物质合成线路如图224所示:
已知:Ⅰ.C为气体,在标准状况下的密度2.5g/L,且核磁共振氢谱中有两组峰,峰面积之比为3:1.I能发生银镜反应且1mol I(C3H4O)能与2mol H2发生加成反应;K的结构具有对称性。
Ⅱ.

Ⅲ.

试回答下列问题:
(1) 写出双安妥明的分子式
(2) C的结构简式为
(3) 反应D→E的反应条件是
(4) 反应“H+K→双安妥明”的化学方程式为
(5) M与H的元素组成相同,相对分子质量比H少14,则同时符合下列条件的M的结构共有
②能与与FeCl3溶液发生显色反应;
③是苯的二元取代物;
(6) 参照上述流程,以丙烯为原料,选用必要的无机试剂合成乳酸(
 ),写出合成路线
),写出合成路线
您最近一年使用:0次
6 . 已知一个碳原子上连有两个羟基时,易发生下列转化:

请根据下图回答:
(1)A中所含官能团的名称为________ 。
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,峰面积之比为2∶2∶2∶3∶3,其中苯环上的一氯代物只有两种。则B的结构简式为________________ 。
(3)写出下列反应的方程式:
①_____________________________________________________________ ;
④_____________________________________________________________ 。
(4)符合下列条件的B的同分异构体共有________ 种。
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相同的位置;
③能发生水解反应和银镜反应。
(5)已知:2RCH2COOC2H5
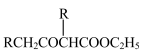 +C2H5OH
+C2H5OH
请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CH2Cl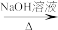 CH3CH2OH
CH3CH2OH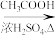 CH3COOC2H5
CH3COOC2H5
_____________________________________________ 。

请根据下图回答:

(1)A中所含官能团的名称为
(2)质谱分析发现B的最大质荷比为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,峰面积之比为2∶2∶2∶3∶3,其中苯环上的一氯代物只有两种。则B的结构简式为
(3)写出下列反应的方程式:
①
④
(4)符合下列条件的B的同分异构体共有
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相同的位置;
③能发生水解反应和银镜反应。
(5)已知:2RCH2COOC2H5

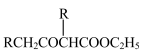 +C2H5OH
+C2H5OH请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CH2Cl
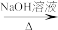 CH3CH2OH
CH3CH2OH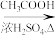 CH3COOC2H5
CH3COOC2H5
您最近一年使用:0次
7 . I. 有机物A只含有C、H、O三种元素,且它们的质量比为9:2:4;A的核磁共振氢谱显示有四种不同类型的氢原子。物质D是一种芳香族化合物,请根据如图(所有无机产物已略去)中各有机物的转化关系回答问题。
已知,两分子醛在一定条件下可以发生如下反应(其中R、R′为H或烃基):

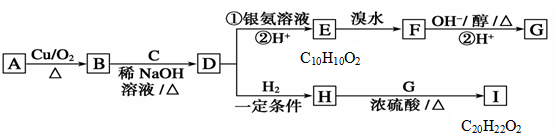
(1)写出物质A的名称:____________ ;C的结构简式:________________ ;
E中含氧官能团的名称:_________________ 。
(2)写出下列反应的有机反应类型:
A→B________________ ; D→H_____________ 。
(3)写出D到E过程中的①的反应化学方程式:______________________ 。
(4)1molF与足量的氢氧化钠水溶液反应最多消耗______ mol NaOH 。
(5)根据题中信息,G的可能结构为_________ 种。
(6)请写出符合下列条件的E的同分异构体的结构简式_________________________ 。
i.该物质水解产物之一为乙酸;ii.苯环上的一氯代物只有两种结构
II.已知:
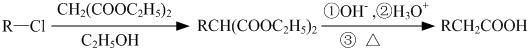
根据已有知识并结合相关信息.写出以乙烯、CH2(COOC2H5)2的乙醇溶液为有机反应原料制HOOCCH2CH2CH2CH2COOH的合成路线流程图(注明反应条件,无机试剂任选)。
_________________________________________________________________
已知,两分子醛在一定条件下可以发生如下反应(其中R、R′为H或烃基):


(1)写出物质A的名称:
E中含氧官能团的名称:
(2)写出下列反应的有机反应类型:
A→B
(3)写出D到E过程中的①的反应化学方程式:
(4)1molF与足量的氢氧化钠水溶液反应最多消耗
(5)根据题中信息,G的可能结构为
(6)请写出符合下列条件的E的同分异构体的结构简式
i.该物质水解产物之一为乙酸;ii.苯环上的一氯代物只有两种结构
II.已知:
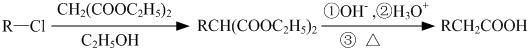
根据已有知识并结合相关信息.写出以乙烯、CH2(COOC2H5)2的乙醇溶液为有机反应原料制HOOCCH2CH2CH2CH2COOH的合成路线流程图(注明反应条件,无机试剂任选)。
您最近一年使用:0次
解题方法
8 . 元素周期表在化学中有举足轻重的地位。请根据提示回答下列问题:
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置_______ 。Fe 分别与硫单质和氯气共热,可以得到两种含铁的二元化合物。请问这两种物质中金属阳离子的未成对电子数之比为_______ 。
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式_______ 。利用铜离子作为中心原子可以形成多种具有良好特性的配合物。我们熟知的是一种深蓝色配合物,向硫酸铜溶液中通入过量氨气,可制备这种深蓝色配合物[Cu(NH3)4]2+。请用适当的化学用语描述该反应过程的实质_______ 。写出[Cu(NH3)4]2+配体的电子式_______ 。
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是_______ 。
(4)CoO 的晶胞如图所示。
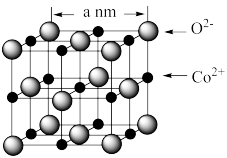
设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为_______ g﹒cm−3(列出计算式即可)
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO 的 VSEPR 模型为
的 VSEPR 模型为_______ ,其中 P 的杂化轨道类型为_______ 。
(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因_______ 。
(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因_______
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因_______ 。
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是
(4)CoO 的晶胞如图所示。

设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO
 的 VSEPR 模型为
的 VSEPR 模型为(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF
 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次
解题方法
9 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
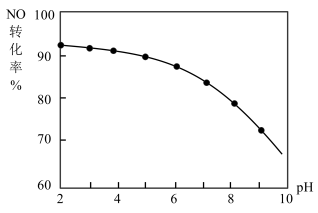
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
您最近一年使用:0次
10 . 甲醇作为一种重要的化工产品广泛应用于多个领域,具有广阔的市场需求和发:展前景。目前甲醇制备的“主流”合成工艺是以合成气(CO、 、
、 )为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:
)为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:
(ⅰ)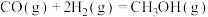

(ⅱ)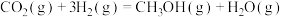
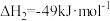
(1)制备过程中副反应 的
的
_______  。
。
(2)甲醇合成的反应机理如图所示(有催化剂M或Cu的部分,表示被M或Cu吸附的原子或原子团)。下列说法正确的是_______。
(3)通过共沉淀法制备多组添加 助剂改性的Cu-ZnO-
助剂改性的Cu-ZnO- (CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%
(CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%  ,13% CO、2%
,13% CO、2%  ,和5%
,和5%  。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:
。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:
从表中数据可知:
①CZA中助剂与基质质量比的最佳值是_______ 。其比值超过该值后,催化效果逐渐降低的原因是______________ 。
②各质量比一定的条件下,阶段Ⅲ中CO的转化率低于阶段1的原因是___ 。若阶段Ⅰ中合成气的总体积为V L,则质量比为0/10时,该阶段的v(CO)=_____ mL/h(结果保留两位小数)。
(4)在密闭容器中充有1mol CO与2mol ,在催化剂作用下反应生成甲醇。CO的平衡转化率(
,在催化剂作用下反应生成甲醇。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。_______ 。
②若A点对应容器的体积为2L,则B点对应反应状态的平衡常数K=_______  。
。
(5)ZnO其中的一种晶体结构与金刚石类似。晶胞中4个Zn占据晶胞内部4个碳原子的位置。若该晶胞参数a=n pm,则该晶胞的密度为__ 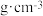 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 、
、 )为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:
)为原料,在一定温度、压力等条件下经过特定催化剂作用而制取。合成过程中的部分反应如下:(ⅰ)
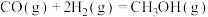

(ⅱ)
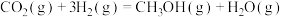
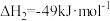
(1)制备过程中副反应
 的
的
 。
。(2)甲醇合成的反应机理如图所示(有催化剂M或Cu的部分,表示被M或Cu吸附的原子或原子团)。下列说法正确的是_______。
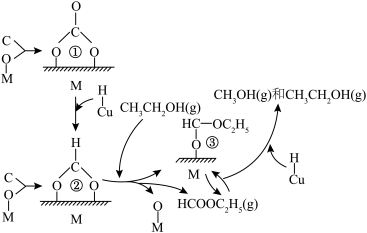
A.示意图完整表示了CO和 合成甲醇的过程 合成甲醇的过程 | B.Cu促进了原子团①到原子团②的转化 |
| C.乙醇在图示的变化过程中起到了催化剂的作用 | D.1mol 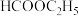 ,转化成为产物,需要2mol H ,转化成为产物,需要2mol H |
(3)通过共沉淀法制备多组添加
 助剂改性的Cu-ZnO-
助剂改性的Cu-ZnO- (CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%
(CZA)基甲醇合成催化剂,利用恒压反应器实验考察不同助剂添加量对合成气制甲醇催化性能的影响。分三个阶段进行评价实验,每阶段实验中合成气组分均为(体积分数):80%  ,13% CO、2%
,13% CO、2%  ,和5%
,和5%  。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:
。阶段Ⅰ:230℃,恒温25h;阶段Ⅱ:提高反应器温度至320℃,恒温25h;阶段Ⅲ:将温度降至230℃,恒温25h。测得各实验阶段不同CZA催化剂样品情况下,折合成相同外界条件下的CO转化率平均值如下表:| CZA中助剂与基质质量比 | 0/10 | 0.5/10 | 1.0/10 | 2.0/10 | 3.0/10 | |
| CO转化率(%) | 阶段Ⅰ | 72.5 | 74.2 | 67.0 | 66.8 | 56.3 |
| 阶段Ⅱ | 19.68 | 20.26 | 19.31 | 19.16 | 16.76 | |
| 阶段Ⅲ | 62.5 | 64.2 | 57.5 | 51.3 | 35.1 | |
①CZA中助剂与基质质量比的最佳值是
②各质量比一定的条件下,阶段Ⅲ中CO的转化率低于阶段1的原因是
(4)在密闭容器中充有1mol CO与2mol
 ,在催化剂作用下反应生成甲醇。CO的平衡转化率(
,在催化剂作用下反应生成甲醇。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。
)与温度(T)、压强(p)的关系如图所示。
②若A点对应容器的体积为2L,则B点对应反应状态的平衡常数K=
 。
。(5)ZnO其中的一种晶体结构与金刚石类似。晶胞中4个Zn占据晶胞内部4个碳原子的位置。若该晶胞参数a=n pm,则该晶胞的密度为
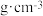 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次



