名校
1 . 聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g)  2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ
(1)碳在元素周期表中的位置是_______ ;C、N、O三种元素的原子半径由小到大的顺序为_______ ;
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
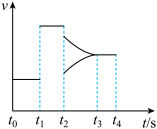
t1时刻表示体系改变的反应条件为_______ ; t2时刻表示体系改变了另一反应条件,此时平衡_______ 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有_______ ;
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率_______ (填“是”或“不是”)所对应温度下的平衡转化率,理由是_______ 。
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为_______ mol∙L−1∙min−1。
 2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ(1)碳在元素周期表中的位置是
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。

t1时刻表示体系改变的反应条件为
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为
您最近一年使用:0次
2023-04-14更新
|
560次组卷
|
4卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(原理综合题)(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练河北省衡水市饶阳中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
2 . 苯基环丁烯酮(PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
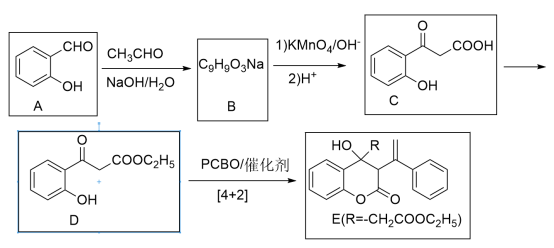
已知如下信息: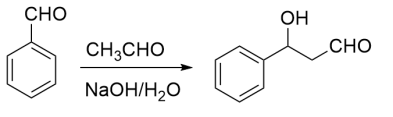
回答下列问题:
(1)A分子中官能团的名称是_______ 。
(2)写出A→B的化学反应方程式_______ 。
(3)C→D的反应类型是_______ 反应;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,依据其结构推断lmol的该副产物在合适条件下最多消耗_______ mol的氢气。
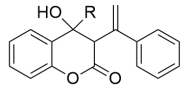
(4)指出化合物E中的手性碳,并用*在图中对应碳原子的上方位置标出_______ 。
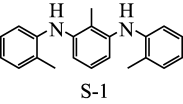
(5)M为C的一种同分异构体,属于芳香族化合物,分子中只有一个取代基。已知1molM可与2mol钠反应能放出1mol氢气;2molM分子间发生取代反应,生成含3个六元环的酯。M的结构简式为_______ 。
(6)以苯甲醛、CH3CHO为原料,其它无机试剂和催化剂任选,写出制备M的转化关系式_______ 。

已知如下信息:

回答下列问题:
(1)A分子中官能团的名称是
(2)写出A→B的化学反应方程式
(3)C→D的反应类型是
(4)指出化合物E中的手性碳,并用*在图中对应碳原子的上方位置标出

(5)M为C的一种同分异构体,属于芳香族化合物,分子中只有一个取代基。已知1molM可与2mol钠反应能放出1mol氢气;2molM分子间发生取代反应,生成含3个六元环的酯。M的结构简式为
(6)以苯甲醛、CH3CHO为原料,其它无机试剂和催化剂任选,写出制备M的转化关系式
您最近一年使用:0次
名校
3 . 电镀污泥(主要含Cr、Cu、Zn、Ni、Fe、Si)中金属大多以氢氧化物的形式存在,硅以SiO2形式存在。某科研团队用萃取——沉淀法回收电镀污泥中金属的技术路线如图所示。
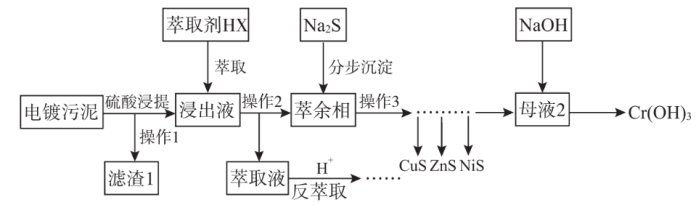
已知:①萃取反应可简单表示为nHX+Mn+ MXn+nH+
MXn+nH+
②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为___ ;滤渣1的主要成分是___ 。
(2)操作2的名称为___ 。
(3)萃取浸出液除去的元素为___ (填元素符号),由于该元素在分步沉淀工序中与硫化钠发生氧化还原反应生成多种沉淀难以分离,故该元素不可在分步沉淀工序中除去,写出此反应的化学方程式___ 。
(4)反萃取工序发生的离子方程式为____ 。
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为___ [通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全,Ksp(NiS)=1×10-19,考虑H2S的二级电离Ka1(H2S)=1×10-7,Ka2(H2S)=1×10-15]。

已知:①萃取反应可简单表示为nHX+Mn+
 MXn+nH+
MXn+nH+②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为
(2)操作2的名称为
(3)萃取浸出液除去的元素为
(4)反萃取工序发生的离子方程式为
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为
您最近一年使用:0次
2021-09-23更新
|
278次组卷
|
2卷引用:河北省省级联测2021-2022学年高三上学期第一次考试化学试题
4 . 金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是_______ 。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________ 。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________ 。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是____________________________________ 。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________ 。
(4)电解法可以提纯粗镓,具体原理如图2所示:
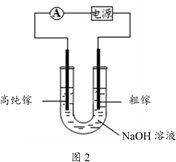
①粗镓与电源____ 极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________ 。
(1) 镓(Ga)的原子结构示意图为
 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

图中A点和C点化学平衡常数的关系是:KA
(4)电解法可以提纯粗镓,具体原理如图2所示:

①粗镓与电源
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
您最近一年使用:0次
5 . (14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:

请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________

请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
您最近一年使用:0次
2022高三·全国·专题练习
6 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中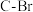 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: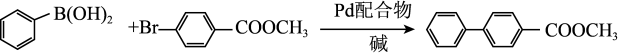
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

回答下列问题:
(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
9070次组卷
|
15卷引用:专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编
(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题
解题方法
7 . 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
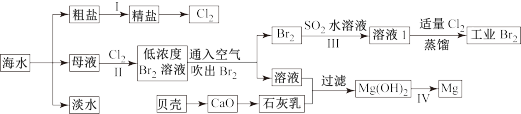
请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式_________________ 。
(2)海水提溴,制得1mol Br2需要消耗_________ mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___________________________ 。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_______________________________ 。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入__________ 溶液。
Ⅱ.(1)Mg在元素周期表中的位置:_____________ ,Mg(OH)2的电子式:____________ ,Mg(OH)2中所含元素的简单离子半径由小到大的顺序是____________________________ 。
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_______________ (填序号)。
A.Mg(OH)2→MgCl2 Mg B. Mg(OH)2
Mg B. Mg(OH)2 MgO
MgO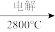 Mg
Mg
C. Mg(OH)2 MgO
MgO  Mg D. Mg(OH)2
Mg D. Mg(OH)2 无水MgCl2
无水MgCl2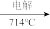 Mg
Mg
(3)判断Mg(OH)2是否洗涤干净的操作是__________________ 。
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
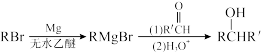 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备 所需溴代烃的可能结构简式:
所需溴代烃的可能结构简式: ___________ 。

请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式
(2)海水提溴,制得1mol Br2需要消耗
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入
Ⅱ.(1)Mg在元素周期表中的位置:
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是
A.Mg(OH)2→MgCl2
 Mg B. Mg(OH)2
Mg B. Mg(OH)2 MgO
MgO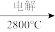 Mg
MgC. Mg(OH)2
 MgO
MgO  Mg D. Mg(OH)2
Mg D. Mg(OH)2 无水MgCl2
无水MgCl2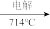 Mg
Mg(3)判断Mg(OH)2是否洗涤干净的操作是
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
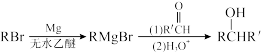 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备 所需溴代烃的可能结构简式:
所需溴代烃的可能结构简式:
您最近一年使用:0次
名校
8 . 工业上用废料制备 的工艺流程如图所示:
的工艺流程如图所示:
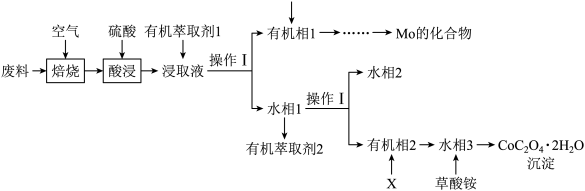
已知:①废料中主要含有 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;
②焙烧时,Mo元素转化为 ;
;
③浸取液中金属离子以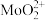 、
、 、
、 形式存在;
形式存在;
④25℃时, 的
的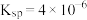 。
。
回答下列问题:
(1)Co元素在元素周期表中的位置是___________ 。已知Mo的核电荷数为42,Mo(IV)离子的价层电子排布式是___________ 。
(2)焙烧时,发生氧化反应的元素有___________ (填元素符号)。标准状况下33.6L 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为___________ 。
(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为___________ 。
(4)在实验室进行操作I,所用到的玻璃仪器有___________ 。
(5)萃取 “的原理是“
“的原理是“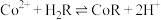 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有___________ ,加入试剂X是___________ (填名称),假定水相3中 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中 最小值的计算式为
最小值的计算式为___________ mol/L(用含c的计算式表示)。
(6)在空气中加热10.98g ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为___________ 。
 的工艺流程如图所示:
的工艺流程如图所示:
已知:①废料中主要含有
 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;②焙烧时,Mo元素转化为
 ;
;③浸取液中金属离子以
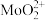 、
、 、
、 形式存在;
形式存在;④25℃时,
 的
的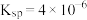 。
。回答下列问题:
(1)Co元素在元素周期表中的位置是
(2)焙烧时,发生氧化反应的元素有
 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为
(4)在实验室进行操作I,所用到的玻璃仪器有
(5)萃取
 “的原理是“
“的原理是“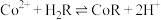 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中 最小值的计算式为
最小值的计算式为(6)在空气中加热10.98g
 ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 210~320 | 4.82 |
| 890~920 | 4.50 |
您最近一年使用:0次
2022-09-25更新
|
403次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高三上学期适应性月考卷(二)化学试题
解题方法
9 . 有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
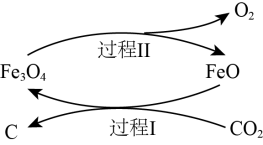
①碳在元素周期表中的位置是_______________ 。
②整个过程中FeO的作用是__________________ 。
③写出CO2转化为炭黑的总反应化学方程式__________________ 。
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
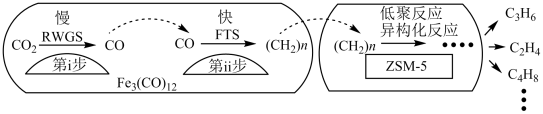
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________ 助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________ 。
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
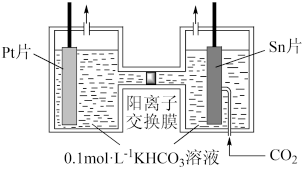
①写出阴极CO2还原为HCOO−的电极反应式:________________________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____________________ 。
(1)新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。

①碳在元素周期表中的位置是
②整个过程中FeO的作用是
③写出CO2转化为炭黑的总反应化学方程式
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率 (%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加
②加入助剂能提高单位时间内乙烯产量的根本原因是
(3)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
您最近一年使用:0次
10 . X、W、Y、Z、M、Q、R、L是元素周期表前四周期元素,且原子序数依次增大,其相关信息如表:
请用化学用语填空:
(1)X元素在元素周期表的位置:_______ 。
(2)请写出Q元素基态原子核外电子排布式:_______ 。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是_______ (用元素符号表示)。
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是_______ 。
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:_______ ;M、Z晶体都是由金属原子密置层在三维空间堆积而成(最密堆积),M的熔点(930K)比Z的熔点(371K)高,原因是_______ ;已知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(6)硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子序数为_______ ,其最高价氧化物对应的水化物化学式为_______ 。
(7)X射线衍射法可以测定某些分子结构,NH3分子结构为_______ ;其电子式为_______ ,中心原子的杂化类型_______ 。
(8)L的基态原子价电子轨道表示式为_______ ;在周期表中该原子排在_______ 区。
(9)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在_______ 。
(10)三氟乙酸乙酯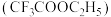 是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性
是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性_______ 乙酸的酸性(填“大于”或“小于”),请理论解释原因_______ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能 依次为578、1817、2745、11575、14830、18376 依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| L | 基态原子核外有四个电子层,最外层只有一个电子,其它电子层均排满电子 |
(1)X元素在元素周期表的位置:
(2)请写出Q元素基态原子核外电子排布式:
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:
(6)硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子序数为
(7)X射线衍射法可以测定某些分子结构,NH3分子结构为
(8)L的基态原子价电子轨道表示式为
(9)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在
(10)三氟乙酸乙酯
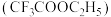 是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性
是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性
您最近一年使用:0次



