1 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
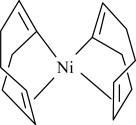
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(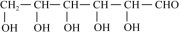 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
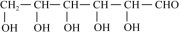 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
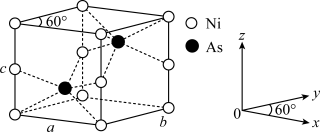
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
2023高三·全国·专题练习
2 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:
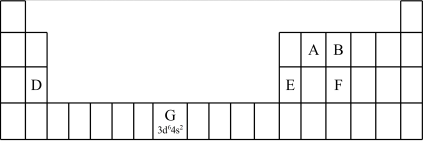
①在元素周期表中,第ⅠB、ⅡB元素属于___________ 区。
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的___________ ,该元素M能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D___________ E(填“>”“<”或“=”)。
②气态氢化物的沸点:B___________ F(填“>”“<”或“=”),理由是___________ 。
(1)认识元素周期表的结构:

①在元素周期表中,第ⅠB、ⅡB元素属于
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素,则下列说法正确的是
a.113号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
真题
名校
3 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
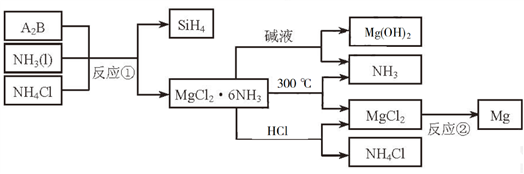
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备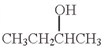 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
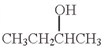 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
3026次组卷
|
13卷引用:2018年全国普通高等学校招生统一考试化学(天津卷)
2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题
4 . 锗是重要的半导体材料,但Ge是地球上最分散的元素之一,被称为“稀散金属”。现利用云南临沧地区富锗的褐煤矿(锗质量分数约为0.01%~0.05%)提取高纯二氧化锗,其工艺流程如图所示:
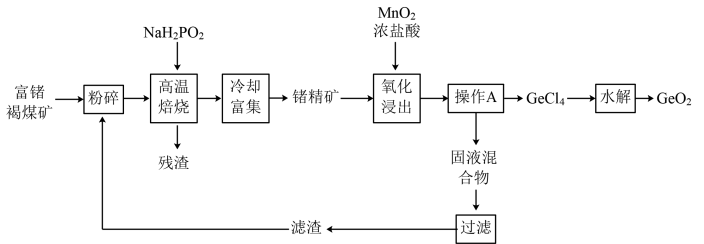
已知含锗化合物的物理性质如下表:
回答下列问题:
(1)Ge的原子序数为32,Ge在元素周期表中的位置是_______ 。
(2)对富锗褐煤矿进行“粉碎”的目的是_______ 。
(3)高温焙烧过程中, 可将
可将 转化为GeO,同时生成
转化为GeO,同时生成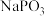 ,试写出该转化过程的化学方程式
,试写出该转化过程的化学方程式_______ 。高温焙烧过程中加入 的目的是
的目的是_______ 。
(4)在“氧化浸出”过程中,反应温度过高时发生的副反应的离子方程式为_______ 。
(5)“氧化浸出”过程中加入过量浓盐酸,其作用除了可以将 转化为
转化为 外,还能
外,还能_______ ,从而提高 的产率。
的产率。
(6)操作A的名称为_______ 。

已知含锗化合物的物理性质如下表:
| 物质 | GeO |  |  |
| 熔点/℃ | 700(升华) | 1116 |  |
| 沸点/℃ | - | 1200 | 86.5 |
回答下列问题:
(1)Ge的原子序数为32,Ge在元素周期表中的位置是
(2)对富锗褐煤矿进行“粉碎”的目的是
(3)高温焙烧过程中,
 可将
可将 转化为GeO,同时生成
转化为GeO,同时生成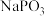 ,试写出该转化过程的化学方程式
,试写出该转化过程的化学方程式 的目的是
的目的是(4)在“氧化浸出”过程中,反应温度过高时发生的副反应的离子方程式为
(5)“氧化浸出”过程中加入过量浓盐酸,其作用除了可以将
 转化为
转化为 外,还能
外,还能 的产率。
的产率。(6)操作A的名称为
您最近一年使用:0次
2022-03-10更新
|
179次组卷
|
2卷引用:广东省珠海市2021-2022学年高三上学期期末考试化学试题
名校
解题方法
5 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,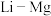 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
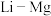 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
名校
6 . a、b、c、d、e、f、g是元素周期表前四周期中的元素,且原子序数依次增大,部分元素的相关信息如表所示。
请回答下列问题:
(1) 在元素周期表中的
在元素周期表中的___________ (填“s”、“p”、“d”或“ ”)区,写出基态
”)区,写出基态 原子的轨道表示式:
原子的轨道表示式:___________ 。
(2)a、b、c的最简单氢化物的沸点由高到低的顺序为___________ (用化学式表示)。
(3)从微观角度分析:为什么 单质的熔、沸点高于
单质的熔、沸点高于 单质的熔、沸点?
单质的熔、沸点?___________ 。
(4)a、b、c三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(5) 常温下呈液态,熔点为
常温下呈液态,熔点为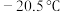 ,沸点为
,沸点为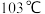 ,易溶于非极性溶剂,
,易溶于非极性溶剂,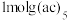 中含有
中含有___________  键,中心原子
键,中心原子 的杂化方式为
的杂化方式为___________ (填标号)。
A. 杂化 B.
杂化 B. 杂化 C.
杂化 C. 杂化 D.
杂化 D. 杂化
杂化
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素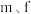 形成的化合物在气态时有单体
形成的化合物在气态时有单体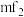 和二聚体
和二聚体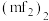 ,在晶体中便形成多聚体
,在晶体中便形成多聚体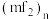 。其中二聚体
。其中二聚体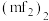 和多聚体
和多聚体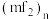 的结构如图所示:
的结构如图所示:
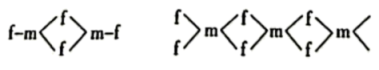
则在二聚体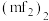 和多聚体
和多聚体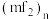 中
中 原子的杂化轨道类型依次为
原子的杂化轨道类型依次为___________ ,单体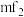 空间结构为
空间结构为___________ 形。
 | 核外电子总数等于 的最外层电子数 的最外层电子数 |
 | 基态原子中 电子总数与 电子总数与 电子总数相等 电子总数相等 |
 | 短周期元素中金属性最强的元素 |
 | 基态原子价层电子排布式为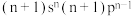 |
 | 基态原子的最外层 轨道有2个电子的自旋状态与其他电子的自旋状态相反 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
 | 其单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(1)
 在元素周期表中的
在元素周期表中的 ”)区,写出基态
”)区,写出基态 原子的轨道表示式:
原子的轨道表示式:(2)a、b、c的最简单氢化物的沸点由高到低的顺序为
(3)从微观角度分析:为什么
 单质的熔、沸点高于
单质的熔、沸点高于 单质的熔、沸点?
单质的熔、沸点?(4)a、b、c三种元素的电负性由高到低的排列次序为
(5)
 常温下呈液态,熔点为
常温下呈液态,熔点为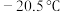 ,沸点为
,沸点为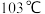 ,易溶于非极性溶剂,
,易溶于非极性溶剂,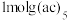 中含有
中含有 键,中心原子
键,中心原子 的杂化方式为
的杂化方式为A.
 杂化 B.
杂化 B. 杂化 C.
杂化 C. 杂化 D.
杂化 D. 杂化
杂化(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素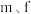 形成的化合物在气态时有单体
形成的化合物在气态时有单体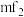 和二聚体
和二聚体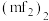 ,在晶体中便形成多聚体
,在晶体中便形成多聚体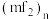 。其中二聚体
。其中二聚体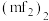 和多聚体
和多聚体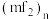 的结构如图所示:
的结构如图所示: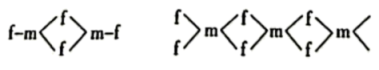
则在二聚体
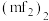 和多聚体
和多聚体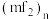 中
中 原子的杂化轨道类型依次为
原子的杂化轨道类型依次为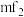 空间结构为
空间结构为
您最近一年使用:0次
解题方法
7 . 中国冶金报指出,钢铁行业作为国民经济重要的基础产业,碳排放量在国内占比13-15%,因此钢铁行业应承担起碳减排的主体责任,努力成为碳减排的先行者。已知,铁有α、γ、δ三种晶体结构,并且在一定条件下可以相互转化(如图),请回答相关的问题:
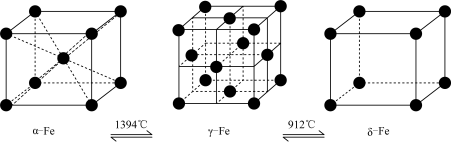
(1)铁元素在元素周期表中的位置_______ ,Fe2+的外围电子排布式_______ ,铁的三种晶体之间的转化属于_______ 变化(填“物理”或“化学”),理由是:_______ 。
(2)铁的α、γ、δ三种晶体结构中,Fe原子的配位数之比为:_______ 。
(3)设α-Fe晶胞边长为a cm,δ-Fe晶胞边长为b cm, 计算确定:两种晶体的密度比为:_______ 。(用a、b的代数式表示)
(4)Fe3C是工业炼铁生产过程中产生的一种铁的合金,在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围,成八面体结构,即碳原子配位数为6,那么,铁原子配位数为_______ 。
(5)事实上,Fe3C是C与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙),根据相关信息,你认为形成碳化铁的铁的三种晶体结构中,最有可能的是:_______ ,(选填“α-Fe”、“γ-Fe”或“δ-Fe”)
(6)摩尔盐[ (NH4)2 SO4·FeSO4·6H2O]是一种复盐, 它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化,试分析该晶体中亚铁离子可稳定存在的原因_______ 。

(1)铁元素在元素周期表中的位置
(2)铁的α、γ、δ三种晶体结构中,Fe原子的配位数之比为:
(3)设α-Fe晶胞边长为a cm,δ-Fe晶胞边长为b cm, 计算确定:两种晶体的密度比为:
(4)Fe3C是工业炼铁生产过程中产生的一种铁的合金,在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围,成八面体结构,即碳原子配位数为6,那么,铁原子配位数为
(5)事实上,Fe3C是C与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙),根据相关信息,你认为形成碳化铁的铁的三种晶体结构中,最有可能的是:
(6)摩尔盐[ (NH4)2 SO4·FeSO4·6H2O]是一种复盐, 它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化,试分析该晶体中亚铁离子可稳定存在的原因
您最近一年使用:0次
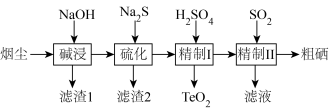
8 . 工业上利用冶炼烟尘(主要成分TeO2、SeO2、PbO、Au、Ag等)回收Se、TeO2的工艺流程如下:
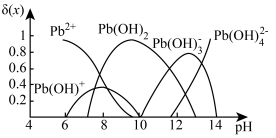
已知:①水溶液中各形态铅的分布系数 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为__ 。
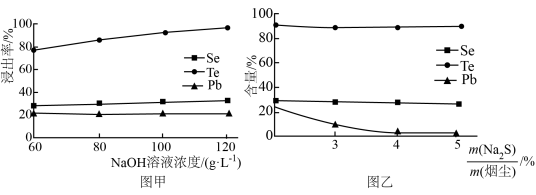
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为__ 100g/L,浓度不能过大的原因是__ ;硫化时,Na2S加入量对元素含量的影响如图乙所示,反应的离子方程式为__ 。
(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是__ (用离子方程式表示),pH过低还会导致沉磅率降低的原因是__ 。
(4)精制Ⅱ后的滤液可循环使用,应当导入到__ 操作中(填操作单元的名称)。
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为__ 。测定原理为:SeO2+4I-+4H+=Se+2I2+2H2O;I2+2S2O =2I-+S4O
=2I-+S4O

已知:①水溶液中各形态铅的分布系数
 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为

(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是
(4)精制Ⅱ后的滤液可循环使用,应当导入到
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为
 =2I-+S4O
=2I-+S4O
您最近一年使用:0次
解题方法
9 . 五种短周期主族元素的原子半径与常见化合价的关系如图所示,E原子能量最高电子层为 M 层。

回答下列问题:
(1)A元素在元素周期表中的位置为___________ 。
(2) A、D的简单氢化物之间反应生成M,M的电子式为______ 。
(3)B分别与C、E组成的两种化合物之间能发生化合反应同时又是氧化还原反应,写出该反应的化学方程式:___________ 。
(4)在酚酞溶液中加入化合物 EDB粉末,可能观察到的现象是______ 。
(5)A和B 可组成多种化合物,其中一种化合物显红棕色,该化合物是___________ (填化学式)。
(6)向E2C溶液中通入足量D的单质,在反应后的溶液中滴加D的氢化物水溶液和BaCl2溶液,产生白色沉淀。写出E2C溶液和足量D的单质反应的离子方程式:___________ 。

回答下列问题:
(1)A元素在元素周期表中的位置为
(2) A、D的简单氢化物之间反应生成M,M的电子式为
(3)B分别与C、E组成的两种化合物之间能发生化合反应同时又是氧化还原反应,写出该反应的化学方程式:
(4)在酚酞溶液中加入化合物 EDB粉末,可能观察到的现象是
(5)A和B 可组成多种化合物,其中一种化合物显红棕色,该化合物是
(6)向E2C溶液中通入足量D的单质,在反应后的溶液中滴加D的氢化物水溶液和BaCl2溶液,产生白色沉淀。写出E2C溶液和足量D的单质反应的离子方程式:
您最近一年使用:0次
解题方法
10 . 以苯为原料合成F,转化关系如下:

F是一种具有重要工业价值的芳香化合物,含有C、H、O、N 四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠反应,试剂②为Fe/HCl。已知:
①
② 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化
③RCOCl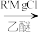 RCOR'
RCOR'
请回答下列问题:
(1)反应① 为加成反应,写出A的化学式_________ 。
(2)B中所含官能团的名称为_______ ;生成B时,常伴有附反应发生,反应所得产物除B外可能还含有____________ (写出一种的结构简式)。
(3)试剂①是指_________ ;试剂①和试剂②的顺序能否互换________ ;为什么?________ 。
(4)E生成F的化学方程式___________________ 。
(5)参照上述合成路线,以(CH3)2CHCHO为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线。________________ 。

F是一种具有重要工业价值的芳香化合物,含有C、H、O、N 四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠反应,试剂②为Fe/HCl。已知:
①

②
 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化③RCOCl
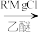 RCOR'
RCOR'请回答下列问题:
(1)反应① 为加成反应,写出A的化学式
(2)B中所含官能团的名称为
(3)试剂①是指
(4)E生成F的化学方程式
(5)参照上述合成路线,以(CH3)2CHCHO为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线。
您最近一年使用:0次



