1 . 硒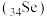 是一种应用广泛的元素。
是一种应用广泛的元素。
Ⅰ.检测细胞体内的
风湿性关节炎与细胞体内产生的 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。 位于元素周期表中
位于元素周期表中_____________ 区(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
② 的结构式是
的结构式是_____________ 。
(2)在 中,
中, 转化为
转化为 。
。 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子__________ 。
② 中,
中, 与
与 的物质的量之比为
的物质的量之比为_________________ 。
Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。_________________ 。
②晶胞中“ ”表示
”表示_________________ (填离子符号)。
(4)新型镁电池放电时,图1晶胞中 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的_____________________ (填序号)。
 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
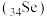 是一种应用广泛的元素。
是一种应用广泛的元素。Ⅰ.检测细胞体内的

风湿性关节炎与细胞体内产生的
 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。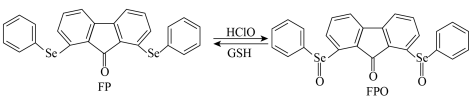
 位于元素周期表中
位于元素周期表中 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。②
 的结构式是
的结构式是(2)在
 中,
中, 转化为
转化为 。
。
 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子②
 中,
中, 与
与 的物质的量之比为
的物质的量之比为Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。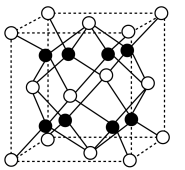
②晶胞中“
 ”表示
”表示(4)新型镁电池放电时,图1晶胞中
 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
您最近一年使用:0次
名校
2 . 钒属于稀有金属,在天然矿物中含量很低。从硫酸厂废弃的钒触媒(主要成分为 、
、 、
、 、
、 )中回收
)中回收 的流程如图所示。
的流程如图所示。
(1)V元素在元素周期表中的位置为___________ 。
(2)“活化焙烧”的目的是使 转化为
转化为 。已知反应过程中
。已知反应过程中 能被
能被 氧化生成
氧化生成 ,
, 自身分解也可以生成
自身分解也可以生成 ,则该步骤所得尾气中硫元素的主要存在形式有
,则该步骤所得尾气中硫元素的主要存在形式有___________ (填化学式)。
(3)常温下稀 溶液的pH
溶液的pH___________ 7(填“>”“<”或“=”,已知 的
的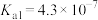 ,
, ,
, 的
的 )。“浸出”步骤中有
)。“浸出”步骤中有 生成,写出该步骤中
生成,写出该步骤中 转化为
转化为 的离子方程式
的离子方程式___________ 。“活化焙烧”时可能有少量的 未完全转化,推测“浸出”步骤中加入少量
未完全转化,推测“浸出”步骤中加入少量 的主要作用是
的主要作用是___________ 。
(4)“浓缩”后,溶液中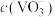 的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
___________ mol/L[ ,假设沉钒过程中溶液体积不变]。
,假设沉钒过程中溶液体积不变]。
(5)含钒离子在储能领域应用广泛。如图所示的全钒液储能电池装置可实现化学能和电能相互转化,该装置储能时电势高的电极的电极反应式为___________ ,若储能时转移2mol电子,则正极液储罐中 的净变化为
的净变化为___________ mol。
 、
、 、
、 、
、 )中回收
)中回收 的流程如图所示。
的流程如图所示。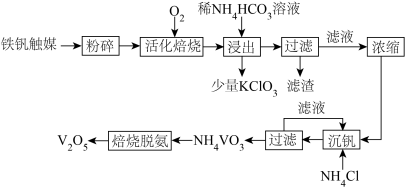
(1)V元素在元素周期表中的位置为
(2)“活化焙烧”的目的是使
 转化为
转化为 。已知反应过程中
。已知反应过程中 能被
能被 氧化生成
氧化生成 ,
, 自身分解也可以生成
自身分解也可以生成 ,则该步骤所得尾气中硫元素的主要存在形式有
,则该步骤所得尾气中硫元素的主要存在形式有(3)常温下稀
 溶液的pH
溶液的pH 的
的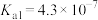 ,
, ,
, 的
的 )。“浸出”步骤中有
)。“浸出”步骤中有 生成,写出该步骤中
生成,写出该步骤中 转化为
转化为 的离子方程式
的离子方程式 未完全转化,推测“浸出”步骤中加入少量
未完全转化,推测“浸出”步骤中加入少量 的主要作用是
的主要作用是(4)“浓缩”后,溶液中
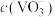 的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
 ,假设沉钒过程中溶液体积不变]。
,假设沉钒过程中溶液体积不变]。(5)含钒离子在储能领域应用广泛。如图所示的全钒液储能电池装置可实现化学能和电能相互转化,该装置储能时电势高的电极的电极反应式为
 的净变化为
的净变化为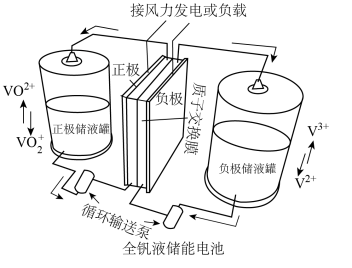
您最近一年使用:0次
2024-05-27更新
|
48次组卷
|
2卷引用:2024届甘肃省民乐县第一中学高三下学期5月模拟考试化学试卷
解题方法
3 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:________ (填字母)。
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________ ,电负性Si________ H(填“>”或“<”)。
②该反应的化学方程式为________ 。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
(4)写出基态Ga原子价层电子排布式________ 。
(5)As的第一电离能比Se大的主要原因是:________________ 。
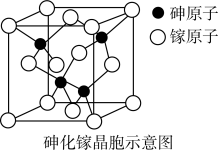
(6)下图为砷化镓晶胞示意图,写出其化学式________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
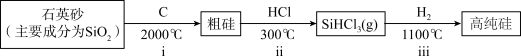
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为
②该反应的化学方程式为
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
| Si | |||
| Ga | As | Se |
(4)写出基态Ga原子价层电子排布式
(5)As的第一电离能比Se大的主要原因是:
(6)下图为砷化镓晶胞示意图,写出其化学式
您最近一年使用:0次
4 . 三种有机物A、B、C互为同分异构体,均由C、H、O三种元素组成,且分子中C、H、O元素的质量比为15:2:8,其相对分子质量通过质谱法测得为100。又知化合物A能发生银镜反应,属于直链结构,分子中有3种不同化学环境的氢,且原子个数比为1:1:2。B为五元环酯。C的红外光谱表明其分子中存在甲基。其它物质的转化关系如下:
完成下列填空:
(1)A的分子式是______________ ,A分子中的官能团名称是_________________ 。
(2)B和G的结构简式分别是_____________ 、_____________ 。
(3)D→C反应的化学方程式为_________________________________________ 。
(4)由单体F发生加聚反应生成的产物的结构简式是___________ 。
(5)试设计一条以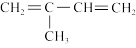 为主要原料制备
为主要原料制备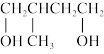 的合成路线
的合成路线_____ ,(合成路线常用的表示方式为:甲 乙
乙
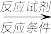 目标产物)
目标产物)
完成下列填空:
(1)A的分子式是
(2)B和G的结构简式分别是
(3)D→C反应的化学方程式为
(4)由单体F发生加聚反应生成的产物的结构简式是
(5)试设计一条以
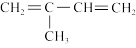 为主要原料制备
为主要原料制备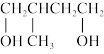 的合成路线
的合成路线 乙
乙
 目标产物)
目标产物)
您最近一年使用:0次
名校
解题方法
5 . 化合物H是抗肿瘤药泰泽司他的中间体,其合成路线如图:
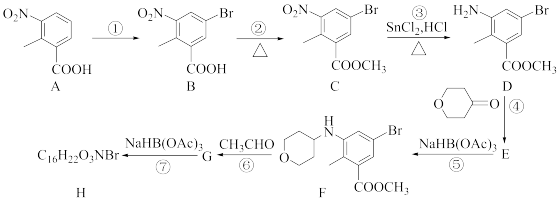
已知:①
②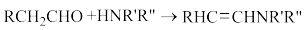 ;
;
③苯环土取代基定位原则(苯环上有该取代基后,下一个取代基在苯环上与该取代基的相对位置):—CH2OH为邻、对位定位基,—CHO为间位定位基。
回答下列问题:
(1)实现反应①的转化,所需试剂除A外还有___________ 。
(2)化合物B中不含氧官能团名称为___________ ;
(3)反应⑤的反应类型为___________ ;化合物G的结构简式为___________ 。
(4)满足下列条件的A的同分异构体的结构简式为___________ 、___________ 。
①含有苯环,且苯环上有5个取代基;②可发生银镜反应;③可与氯化铁溶液发生显色反应;④核磁共振氢谱有4组峰,峰面积之比为1:2:2:2。
(5)已知酯可以水解生成醇,也可以氨解生成醇,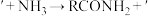 。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为
。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为___________ 。
(6)参照题干中的合成路线,设计以苯甲醇为主要原料,制备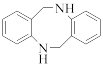 的合成路线
的合成路线___________ (无机试剂任选)。

已知:①

②
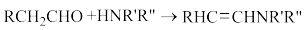 ;
;③苯环土取代基定位原则(苯环上有该取代基后,下一个取代基在苯环上与该取代基的相对位置):—CH2OH为邻、对位定位基,—CHO为间位定位基。
回答下列问题:
(1)实现反应①的转化,所需试剂除A外还有
(2)化合物B中不含氧官能团名称为
(3)反应⑤的反应类型为
(4)满足下列条件的A的同分异构体的结构简式为
①含有苯环,且苯环上有5个取代基;②可发生银镜反应;③可与氯化铁溶液发生显色反应;④核磁共振氢谱有4组峰,峰面积之比为1:2:2:2。
(5)已知酯可以水解生成醇,也可以氨解生成醇,
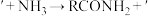 。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为
。化合物D通过聚合反应可形成一种高分于;该反应的化学方程式为(6)参照题干中的合成路线,设计以苯甲醇为主要原料,制备
 的合成路线
的合成路线
您最近一年使用:0次
2023-05-04更新
|
532次组卷
|
2卷引用:湖南师范大学附属中学2023届高三下学期模拟考试(二)化学试题
6 . 铟(In)是制造半导体、电光源等的重要原料,广泛用于航空航天、光电信息、太阳能电池等领域,从铜冶炼过程中产生的铟砷烟灰(主要成分为难溶于水的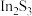 、
、 ,还含有ZnO、PbO、
,还含有ZnO、PbO、 、
、 等杂质)中提取锢的流程如下图所示
等杂质)中提取锢的流程如下图所示 价离子形式存在;
价离子形式存在;
②萃取剂可以用 表示,可在酸性溶液中萃取
表示,可在酸性溶液中萃取 价的金属离子
价的金属离子
回答下列问题:
(1)铟在元素周期表中的位置为___________ 。
(2)氧化酸浸过程中,硫元素被氧化为最高化合价,写出发生此转化反应的离子方程式:___________ 。
(3)还原铁步骤的目的是___________ 。
(4)实验室进行萃取操作时首先需要___________ ,萃取时若温度过高会使萃取剂挥发过快,造成的不利影响是___________ 。
(5)萃取过程中发生的主要反应为 ,则反萃取时需要加入的试剂为
,则反萃取时需要加入的试剂为___________ (填名称)。
(6)已知置换步骤会产生易燃易爆性气体单质,写出该步骤的化学方程式___________ ,置换后所得的粗铟需要洗涤,检验其已洗净的操作和现象为___________ 。
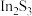 、
、 ,还含有ZnO、PbO、
,还含有ZnO、PbO、 、
、 等杂质)中提取锢的流程如下图所示
等杂质)中提取锢的流程如下图所示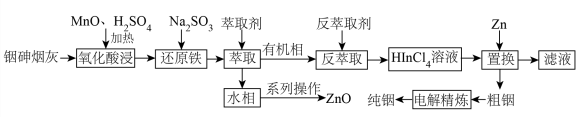
 价离子形式存在;
价离子形式存在;②萃取剂可以用
 表示,可在酸性溶液中萃取
表示,可在酸性溶液中萃取 价的金属离子
价的金属离子回答下列问题:
(1)铟在元素周期表中的位置为
(2)氧化酸浸过程中,硫元素被氧化为最高化合价,写出发生此转化反应的离子方程式:
(3)还原铁步骤的目的是
(4)实验室进行萃取操作时首先需要
(5)萃取过程中发生的主要反应为
 ,则反萃取时需要加入的试剂为
,则反萃取时需要加入的试剂为(6)已知置换步骤会产生易燃易爆性气体单质,写出该步骤的化学方程式
您最近一年使用:0次
7 . 化合物M由两种短周期主族元素组成,在一定条件下可以发生下列转化:
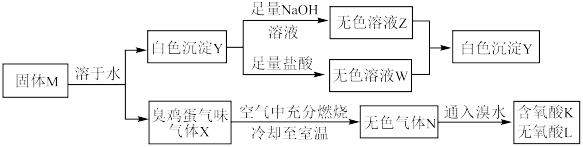
请回答下列问题:
(1)固体M的化学式为___________ 。
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为___________ ,其基态原子中电子的空间运动状态有___________ 种。
(3)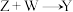 的化学方程式为
的化学方程式为___________ 。
(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为___________ 。
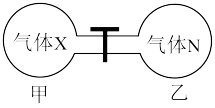
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。
①反应前两容器中的气体密度: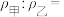
___________ 。
②打开活塞,使气体充分反应,则反应前后的压强: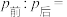
___________ 。
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=___________ 。

请回答下列问题:
(1)固体M的化学式为
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为
(3)
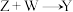 的化学方程式为
的化学方程式为(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。

①反应前两容器中的气体密度:
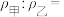
②打开活塞,使气体充分反应,则反应前后的压强:
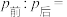
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=
您最近一年使用:0次
2023-11-22更新
|
88次组卷
|
2卷引用:江西省2024届高三上学期11 月一轮总复习调研测试化学试题
解题方法
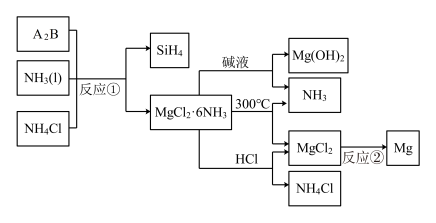
8 . 图中反应 是制备
是制备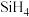 的一种方法,其副产物
的一种方法,其副产物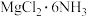 是优质的镁资源。回答下列问题:
是优质的镁资源。回答下列问题:
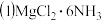 所含元素的简单离子半径由小到大的顺序
所含元素的简单离子半径由小到大的顺序 除外
除外 :
:______ 。
Mg在元素周期表中的位置;______ , 的电子式:
的电子式:______ 。
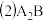 的化学式为
的化学式为______ ,反应 的必备条件是
的必备条件是______ 。上图中可以循环使用的物质有______ 。
 在一定条件下,由
在一定条件下,由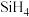 和
和 反应生成
反应生成 和一种固体耐磨材料
和一种固体耐磨材料______  写化学式
写化学式 。
。
 为实现燃煤脱硫,向煤中加入浆状
为实现燃煤脱硫,向煤中加入浆状 ,使燃烧产生的
,使燃烧产生的 转化为稳定的Mg化合物,写出该反应的化学方程式:
转化为稳定的Mg化合物,写出该反应的化学方程式:______ 。
 用Mg制成的格氏试剂
用Mg制成的格氏试剂
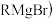 常用于有机合成,例如制备醇类化合物的合成路线如下:
常用于有机合成,例如制备醇类化合物的合成路线如下:
RBr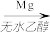 RMgBr
RMgBr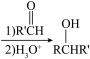
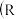 :烃基;R’:烃基或
:烃基;R’:烃基或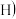
依据上述信息,写出制备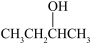 所需醛的可能结构简式:
所需醛的可能结构简式:______ 。
 是制备
是制备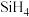 的一种方法,其副产物
的一种方法,其副产物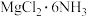 是优质的镁资源。回答下列问题:
是优质的镁资源。回答下列问题:
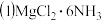 所含元素的简单离子半径由小到大的顺序
所含元素的简单离子半径由小到大的顺序 除外
除外 :
:Mg在元素周期表中的位置;
 的电子式:
的电子式: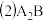 的化学式为
的化学式为 的必备条件是
的必备条件是 在一定条件下,由
在一定条件下,由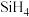 和
和 反应生成
反应生成 和一种固体耐磨材料
和一种固体耐磨材料 写化学式
写化学式 。
。 为实现燃煤脱硫,向煤中加入浆状
为实现燃煤脱硫,向煤中加入浆状 ,使燃烧产生的
,使燃烧产生的 转化为稳定的Mg化合物,写出该反应的化学方程式:
转化为稳定的Mg化合物,写出该反应的化学方程式: 用Mg制成的格氏试剂
用Mg制成的格氏试剂
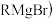 常用于有机合成,例如制备醇类化合物的合成路线如下:
常用于有机合成,例如制备醇类化合物的合成路线如下:RBr
 RMgBr
RMgBr
 :烃基;R’:烃基或
:烃基;R’:烃基或
依据上述信息,写出制备
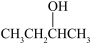 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
名校
解题方法
9 . 某废催化剂主要成分为镍、钒、铁、铝及其硫化物,为实现金属资源的再利用,对其处理的流程如下图所示。

按要求回答下列问题:
(1)Ni在元素周期表中的位置为___________ 。聚合氯化铁的化学式为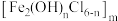 ,其中铁元素的化合价为
,其中铁元素的化合价为___________ 。
(2)“滤液”的处理
①“滤液”中,阴离子主要有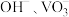 和
和___________ 。
②从“滤液”中获取钒单质的流程如下图所示,其中“离子交换”和“洗脱”可简单表示为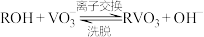 (其中ROH为离子交换树脂)。
(其中ROH为离子交换树脂)。
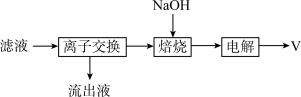
向流出液中通入过量 可得到沉淀,该沉淀的化学式为
可得到沉淀,该沉淀的化学式为___________ 。“电解”时阴极的电极反应为___________ ,阴极可能产生的气体副产物为___________ 。
(3)聚合氯化铁的制备
①“转化”过程中,实际加入 的量远大于按方程式计算所需的量,其原因为
的量远大于按方程式计算所需的量,其原因为___________ 。
②“转化”过程中,溶液的 必须控制在一定的范围内。
必须控制在一定的范围内。 偏小时
偏小时___________ , 偏大时则形成
偏大时则形成 沉淀。
沉淀。
(4)氯化镍晶体 (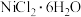 )纯度的测定(杂质不含氯元素)
)纯度的测定(杂质不含氯元素)
ⅰ.用适量蒸馏水溶解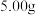 样品,再稀释至
样品,再稀释至 。
。
ⅱ.取 待测液,加入指示剂,用
待测液,加入指示剂,用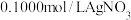 标准液滴定,多次平行实验情况如下表和下图所示。
标准液滴定,多次平行实验情况如下表和下图所示。

ⅲ.另取 蒸馏水,进行空白对照实验,消耗标准液的平均用量为
蒸馏水,进行空白对照实验,消耗标准液的平均用量为 。
。
① 标准液滴定溶液中的
标准液滴定溶液中的 ,采用
,采用 为指示剂,利用
为指示剂,利用 与
与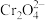 生成砖红色沉淀,指示达到终点。当达到滴定终点时,溶液中的
生成砖红色沉淀,指示达到终点。当达到滴定终点时,溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 ),此时溶液中
),此时溶液中
___________  。[已知:
。[已知: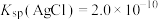 ,
, 。]
。]
②氯化镍晶体的纯度为___________ %。

按要求回答下列问题:
(1)Ni在元素周期表中的位置为
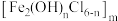 ,其中铁元素的化合价为
,其中铁元素的化合价为(2)“滤液”的处理
①“滤液”中,阴离子主要有
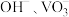 和
和②从“滤液”中获取钒单质的流程如下图所示,其中“离子交换”和“洗脱”可简单表示为
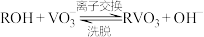 (其中ROH为离子交换树脂)。
(其中ROH为离子交换树脂)。
向流出液中通入过量
 可得到沉淀,该沉淀的化学式为
可得到沉淀,该沉淀的化学式为(3)聚合氯化铁的制备
①“转化”过程中,实际加入
 的量远大于按方程式计算所需的量,其原因为
的量远大于按方程式计算所需的量,其原因为②“转化”过程中,溶液的
 必须控制在一定的范围内。
必须控制在一定的范围内。 偏小时
偏小时 偏大时则形成
偏大时则形成 沉淀。
沉淀。(4)氯化镍晶体 (
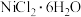 )纯度的测定(杂质不含氯元素)
)纯度的测定(杂质不含氯元素)ⅰ.用适量蒸馏水溶解
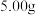 样品,再稀释至
样品,再稀释至 。
。ⅱ.取
 待测液,加入指示剂,用
待测液,加入指示剂,用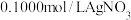 标准液滴定,多次平行实验情况如下表和下图所示。
标准液滴定,多次平行实验情况如下表和下图所示。
| 滴定次数 | 标准液体积 | |
滴定前的刻度 | 滴定终点的刻度 | |
| 第1次 | 2.35 |  |
| 第2次 | 0.70 | 20.85 |
| 第3次 | 0.75 | 22.90 |
 蒸馏水,进行空白对照实验,消耗标准液的平均用量为
蒸馏水,进行空白对照实验,消耗标准液的平均用量为 。
。①
 标准液滴定溶液中的
标准液滴定溶液中的 ,采用
,采用 为指示剂,利用
为指示剂,利用 与
与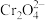 生成砖红色沉淀,指示达到终点。当达到滴定终点时,溶液中的
生成砖红色沉淀,指示达到终点。当达到滴定终点时,溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 ),此时溶液中
),此时溶液中
 。[已知:
。[已知: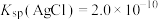 ,
, 。]
。]②氯化镍晶体的纯度为
您最近一年使用:0次
名校
10 . 聚丙烯腈纤维俗名人造羊毛,由丙烯腈聚合而得。用丙烯合成丙烯腈的反应如下: 2C3H6(g)+2NH3(g)+3O2(g)  2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ
(1)碳在元素周期表中的位置是_______ ;C、N、O三种元素的原子半径由小到大的顺序为_______ ;
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。
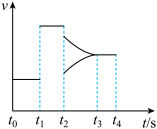
t1时刻表示体系改变的反应条件为_______ ; t2时刻表示体系改变了另一反应条件,此时平衡_______ 移动(填“正向”、“逆向”或“不”)。
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有_______ ;
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率_______ (填“是”或“不是”)所对应温度下的平衡转化率,理由是_______ 。
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为_______ mol∙L−1∙min−1。
 2C3H3N(g)+6H2O(g)+1030kJ
2C3H3N(g)+6H2O(g)+1030kJ(1)碳在元素周期表中的位置是
(2)某密闭容器中发生上述反应,生成丙烯腈的反应速率与反应时间的关系如下图所示。

t1时刻表示体系改变的反应条件为
丙烯的转化率与反应温度的关系如图示:

(3)有利于提高丙烯平衡转化率的反应条件有
(4)最大转化率所对应的温度为460℃。当温度低于460℃时,丙烯的转化率
(5)一定条件下,在2L恒容密闭容器中,通入84g C3H6、34g NH3、96g O2,若该反应5 min到达a点,则0~5min内丙烯的平均反应速率为
您最近一年使用:0次
2023-04-14更新
|
560次组卷
|
4卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(原理综合题)(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练河北省衡水市饶阳中学2022-2023学年高一下学期期末考试化学试题



