1 . 氮及其化合物在工农业生产、生活中被广泛使用,造福人类。
I.元素 X、Y、Z 位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如图)常用作丝绸漂白剂。回答下列问题:
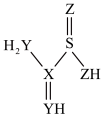
(1)硫元素在元素周期表中的位置为______ ;Y 的元素符号为______ 。
(2)下列说法错误的是______ (选填序号)。
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为 8 电子稳定结构
II.工业上用氨气来制造硝酸,NH3转化关系如图所示。
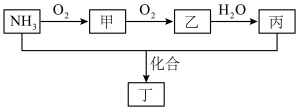
(3)NH3的电子式为______ 。
(4)图中,乙转化为丙的离子方程式为______ 。
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,______ ,将湿润的 红色石蕊试纸置于试管口,试纸变蓝。
(6)工业上常使用 NH3处理甲,生成无污染的 N2,则 NH3与甲完全反应的物质的量之比为______ 。
I.元素 X、Y、Z 位于同一周期且原子序数依次增大,它们和氢元素、硫元素组成的含氮化合物(结构如图)常用作丝绸漂白剂。回答下列问题:

(1)硫元素在元素周期表中的位置为
(2)下列说法错误的是
A.原子半径:X>Y>Z
B.简单气态氢化物稳定性:Y<Z
C.该化合物可溶于水
D.该化合物中所有原子均为 8 电子稳定结构
II.工业上用氨气来制造硝酸,NH3转化关系如图所示。

(3)NH3的电子式为
(4)图中,乙转化为丙的离子方程式为
(5)检验化合物丁中阳离子的方法:取少量待测液于试管中,
(6)工业上常使用 NH3处理甲,生成无污染的 N2,则 NH3与甲完全反应的物质的量之比为
您最近一年使用:0次
2 . 下图表示由元素周期表中1到20号且不同主族的元素组成的单质及化合物之间的转化关系(产物中的水已略去)。其中A为黄绿色气体单质,D有漂白性;在实验室中常用固体B和固体C加热制取刺激性气味F;F和G的组成元素相同,G与H分子所含电子数相同。

请回答
(1)单质A的组成元素在周期表中的位置是________ ;
(2)B的化学式为________ ,F的电子式为________ ,C中所含化学键类型有_______ ;
(3)写出反应②的化学方程式_____________ ;
(4)反应④中F和气体H在空气中相遇时的实验现象为__________ 写出的F一种具体用途_______________ ;
(5)向具有漂白作用的D溶液中加入H的浓溶液有A生成,其反应的离子方程式为______________ 。
(6)砷元素(As)与上述某元素处于同一主族。砷酸铅可用作杀虫剂。已知:
①在砷酸铅中,砷处于最高价态,铅处于稳定价态。
②砷酸铅是正砷酸对应的盐,1mol正砷酸分子中含有8mol原子.
砷的最高价氧化物的化学式为___________ 砷酸铅的化学式为________

请回答
(1)单质A的组成元素在周期表中的位置是
(2)B的化学式为
(3)写出反应②的化学方程式
(4)反应④中F和气体H在空气中相遇时的实验现象为
(5)向具有漂白作用的D溶液中加入H的浓溶液有A生成,其反应的离子方程式为
(6)砷元素(As)与上述某元素处于同一主族。砷酸铅可用作杀虫剂。已知:
①在砷酸铅中,砷处于最高价态,铅处于稳定价态。
②砷酸铅是正砷酸对应的盐,1mol正砷酸分子中含有8mol原子.
砷的最高价氧化物的化学式为
您最近一年使用:0次
3 . 氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________ 。
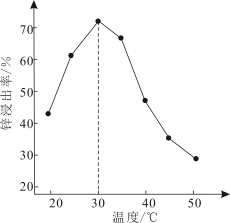
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________ 。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________ 。
(4)“滤渣3”除锌外,主要成分为___________________ 。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________ (写名称)。电解后的电解液经补充_________ (写一种物质的化学式)后可返回至__________________ (填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________ 。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为

(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式
(4)“滤渣3”除锌外,主要成分为
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为
您最近一年使用:0次
解题方法
4 . A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。

请针对以下三种不同情况回答:
 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
 中含有的金属元素在元素周期表中的位置为
中含有的金属元素在元素周期表中的位置为_______________________ ,向水中加入X物质,X对水的电离平衡的影响是_________  填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响” 。
。
 与C的水溶液混合后生成B,反应的离子方程式为
与C的水溶液混合后生成B,反应的离子方程式为___________________________ 。
 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成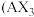 和
和 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为 ,则
,则 单质中含共价键数目为
单质中含共价键数目为_________  ,B的电子式为
,B的电子式为_________ 。
 与水反应的离子方程式为
与水反应的离子方程式为_______________________________________________ 。
 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
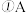 中所含有的化学键类型是
中所含有的化学键类型是_________ 。
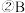 溶液中离子浓度由小到大的顺序是
溶液中离子浓度由小到大的顺序是_________ 。

请针对以下三种不同情况回答:
 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。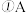 中含有的金属元素在元素周期表中的位置为
中含有的金属元素在元素周期表中的位置为 填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响” 。
。 与C的水溶液混合后生成B,反应的离子方程式为
与C的水溶液混合后生成B,反应的离子方程式为 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成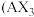 和
和 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为 ,则
,则 单质中含共价键数目为
单质中含共价键数目为 ,B的电子式为
,B的电子式为 与水反应的离子方程式为
与水反应的离子方程式为 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。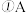 中所含有的化学键类型是
中所含有的化学键类型是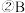 溶液中离子浓度由小到大的顺序是
溶液中离子浓度由小到大的顺序是
您最近一年使用:0次
5 . Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去),已知A由短周期非金属元素组成,B具有漂白性且光照易分解。

(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______________________ ;
②A与H2O反应的离子反应方程式为______________________ ;
③X可能为________ (填代号)。a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为______________________ ;
②A与H2O反应的化学反应方程式为______________________ ;
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(3)请画出沉淀B中金属元素的原子结构示意图______________________ ;
(4)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式______________________ ;
(5)请写出气体C与氯气发生氧化还原反应的化学方程式______________________ 。

(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为
②A与H2O反应的离子反应方程式为
③X可能为
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为
②A与H2O反应的化学反应方程式为
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(3)请画出沉淀B中金属元素的原子结构示意图
(4)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式
(5)请写出气体C与氯气发生氧化还原反应的化学方程式
您最近一年使用:0次
名校
6 . (1)短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
①M在元素周期表中的位置是__________________________ 。
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________ 。
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为_____________ 。
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
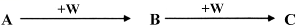
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为________________
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为_______________
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为__________ g,在实验中其它操作均正确,若定容时仰视刻度线,则所得溶液浓度________________ 0.1mol·L-1 (填“大于”“等于”或“小于”)。
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______________
①M在元素周期表中的位置是
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
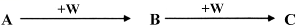
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为
您最近一年使用:0次
名校
7 . Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
(1)M在元素周期表中的位置为________________ 。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________ ;所含化学键类型_________ 。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________ 。
Ⅱ.如下图转化关系: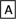
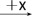
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________ 。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________ 。
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(2)X与Y按原子个数比2∶1构成的物质的电子式为
(3)X+、 Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
Ⅱ.如下图转化关系:
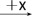
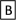
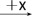
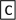
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为
您最近一年使用:0次
2018-11-16更新
|
376次组卷
|
2卷引用:【全国百强校】辽宁省大连市辽宁师范大学附属中学2019届高三上学期第一次考试化学试题
8 . I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________ 。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________ 。
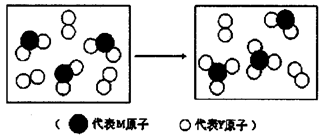
(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________ 。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____ 。B与D所形成的化合物的化学键类型为______ 。
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_________ 。
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为
您最近一年使用:0次
解题方法
9 . A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。
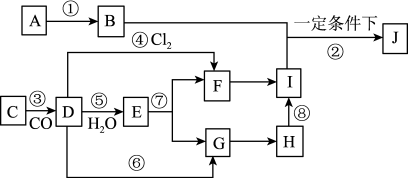
(1) (1)写出物质B的电子式_______ ;D元素在元素周期表中的位置为_______
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式_______
(2) (2)写出下列反应的化学反应方程式:
⑤__________________________________________________________
⑧________________________________________________________________
(3) (3)写出反应的离子方程式:⑦_______
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)_______
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因_______________________________________

(1) (1)写出物质B的电子式
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式
(2) (2)写出下列反应的化学反应方程式:
⑤
⑧
(3) (3)写出反应的离子方程式:⑦
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因
您最近一年使用:0次
10 . A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质。

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式_________________________ 。
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为________________ ,在A生成C的反应中每消耗1mol还原剂,可生成气体_______________ L(标准状况)。
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是________ ,元素a的最高价氧化物对应水化物的水溶液中离子浓度由大到小的顺序为___________ 。

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是
您最近一年使用:0次



