11-12高三上·安徽安庆·阶段练习
1 . 为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是___________________ ,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是___________ 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
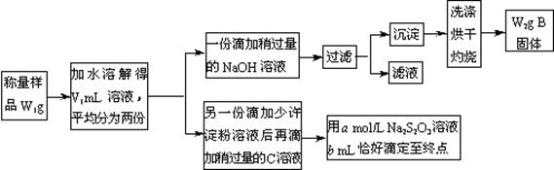
请回答下列问题:
①写出B和C的化学式:B____________ ,C________________ 。
②滴定时,判断滴定达到终点的现象是______________________ 。
③KIO3的质量分数是________________________________ (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)____________
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。

请回答下列问题:
①写出B和C的化学式:B
②滴定时,判断滴定达到终点的现象是
③KIO3的质量分数是
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
您最近一年使用:0次
2 . 某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________ ,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及________________________________
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是_____________________ ,反应的化学方程式是________________________ ,_____________________
(5)该样品中铝的质量分数是:_______________________________ (用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:
(2)步骤③中生成沉淀的离子方程式为:
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是
(5)该样品中铝的质量分数是:
(6)下列因操作不当,会使测定结果偏大的是
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
您最近一年使用:0次
2014·陕西西安·二模
名校
3 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
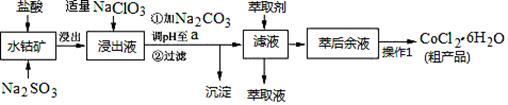
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_________________ 。
(2)写出NaClO3发生反应的主要离子方程式________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为___________________ 。
(4)“操作1”中包含3个基本实验操作,它们依次是_____________ 、____________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是______________ ;其使用的最佳pH范围是_________ 。
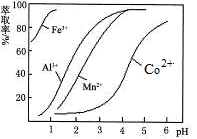
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为
(4)“操作1”中包含3个基本实验操作,它们依次是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
6卷引用:2014届陕西省长安一中等五校高三第二次联考理综化学试卷
4 . 肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。CO(NH2) + 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是____________ ;
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是___________ (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是_________________________________ ;
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式_______________________ ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________________ 。
(4)滴定时,碘的标准溶液盛放在____________ 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_____ (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是:________________ 。
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式
(4)滴定时,碘的标准溶液盛放在
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是:
您最近一年使用:0次
2016-12-09更新
|
107次组卷
|
3卷引用:2015年湖北省荆门市高三元月调考理综化学试卷
5 . 某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:

(1)操作a的名称是_____________ 。
(2)加入足量试剂X后,发生反应的离子方程式为_____________ 、_____________ 。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是_______ 、_________ 。
(4)硫铁矿烧渣中铁元素的质量分数为________ 。

(1)操作a的名称是
(2)加入足量试剂X后,发生反应的离子方程式为
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是
(4)硫铁矿烧渣中铁元素的质量分数为
您最近一年使用:0次
6 . 某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:

已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________ 。试剂X的名称为______________ 。
(2)加入Z的作用是调节溶液的pH,pH范围应为_____ ;下列可作为试剂Z的是_______ 。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是_________ 、_________ 、过滤洗涤即可得硝酸铜晶体。
(4)测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是______ 。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
(5)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________ 。(用m、n的代数式表示)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________ ;____________________________________ 。

已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式
(2)加入Z的作用是调节溶液的pH,pH范围应为
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是
(4)测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
(5)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有
您最近一年使用:0次
2015-06-02更新
|
443次组卷
|
2卷引用:2015届上海市闵行区高三下学期质量调研考试(二模)化学试卷
名校
7 . 现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X___________ 。
(2)鉴别B在溶液中产生的阴离子的实验操作方法是___________ 。
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:___________ 。
ii.B溶液与E沉淀反应的化学方程式:___________ 。
iii.写出B与C反应至溶液呈中性的离子方程式:___________ 。
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为___________ 。
| 阳离子 | Na+、H+、Ba+ |
| 阴离子 | OH-、 、 、 |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X
(2)鉴别B在溶液中产生的阴离子的实验操作方法是
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:
ii.B溶液与E沉淀反应的化学方程式:
iii.写出B与C反应至溶液呈中性的离子方程式:
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为
您最近一年使用:0次
名校
8 . 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①配制0.100 稀盐酸和0.100
稀盐酸和0.100 氢氧化钠溶液;
氢氧化钠溶液;
②取一粒药片(0.10g)研碎后加入20.0 蒸馏水;
蒸馏水;
③用0.100 氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;
氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;
④加入25.0 0.100
0.100 稀盐酸。请回答下列问题:
稀盐酸。请回答下列问题:
(1)测定过程的正确操作顺序为_______________________ (填序号)。
(2)测定过程中发生反应的离子方程式_________________ 、______________________ 。
(3)该测定实验共进行了五次。实验室现有50 、100
、100 、250
、250 、500
、500 4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为
4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为_________ ,理由是______________________ 。
(4)某同学4次测定所消耗的 溶液的体积如下:
溶液的体积如下:
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数____________________ 。
①配制0.100
 稀盐酸和0.100
稀盐酸和0.100 氢氧化钠溶液;
氢氧化钠溶液;②取一粒药片(0.10g)研碎后加入20.0
 蒸馏水;
蒸馏水;③用0.100
 氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;
氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;④加入25.0
 0.100
0.100 稀盐酸。请回答下列问题:
稀盐酸。请回答下列问题:(1)测定过程的正确操作顺序为
(2)测定过程中发生反应的离子方程式
(3)该测定实验共进行了五次。实验室现有50
 、100
、100 、250
、250 、500
、500 4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为
4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为(4)某同学4次测定所消耗的
 溶液的体积如下:
溶液的体积如下:测定次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 13.00 | 12.90 | 12.95 | 13.10 | 13.05 |
您最近一年使用:0次
名校
解题方法
9 . 现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,部分溶于水后电可以产生阳离子Na+、H+、Ba2+,阴离子OH-、CO 、SO
、SO 。为鉴别它们,分别完成以下实验,其结果如下:
。为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的化学式:A___ ,B___ ,C___ ,D___ ,E___ 。
(2)写出C溶液与X气体反应生成沉淀E的离子方程式:___ 。
(3)D与E的混合物a g,加入足量盐酸,反应完毕生成b g气体X,则D在混合物中的质量分数为___ 。
(4)B溶液与A溶液反应至不再产生气泡,写出该反应的离子反应方程式___ 。
 、SO
、SO 。为鉴别它们,分别完成以下实验,其结果如下:
。为鉴别它们,分别完成以下实验,其结果如下:①A溶液与B溶液反应生成无色气体X,X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的化学式:A
(2)写出C溶液与X气体反应生成沉淀E的离子方程式:
(3)D与E的混合物a g,加入足量盐酸,反应完毕生成b g气体X,则D在混合物中的质量分数为
(4)B溶液与A溶液反应至不再产生气泡,写出该反应的离子反应方程式
您最近一年使用:0次
2021-10-20更新
|
160次组卷
|
3卷引用:安徽省合肥市第六中学2020-2021学年高一上学期第一次月考化学试题
解题方法
10 . 为了减少煤燃烧产生的二氧化硫的排放,可以采取各种方法,其中一种方法是使用微生物脱硫技术。煤炭中以FeS2形式存在的硫,在有水和空气存在的条件下,用脱硫微生物起氧化还原作用:在细菌作用下FeS2 中的硫元素首先被氧化最高价态,然后亚铁离子继续被氧化成高价铁离子。
(1)请分别写出上述过程总离子反应方程式___________ 。
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸___________ 吨;硫酸铁___________ 吨。
(1)请分别写出上述过程总离子反应方程式
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸
您最近一年使用:0次




