名校
解题方法
1 . 一种以NH4Cl酸性蚀铜废液[含NH4Cl,Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:

已知:CuCl溶于浓盐酸,难溶于水,不溶于乙醇。
回答下列问题:
(1)“反应1”中,NaCl、Cu与CuSO4反应的离子方程式为__ ;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是__ 。
(2)“水解”步骤中,溶液中的CuCl43-在加入大量水稀释即可析出CuCl,原因是__ (结合离子方程式,从平衡角度分析)。
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为__ 。
(4)“反应2”需加入的试剂X是__ ;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为__ 。
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻菲罗啉作指示剂,立刻用cmol·L-1的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为__ (已知滴定反应为Ce4++Fe2+=Ce3++Fe3+,列出计算式)。

已知:CuCl溶于浓盐酸,难溶于水,不溶于乙醇。
回答下列问题:
(1)“反应1”中,NaCl、Cu与CuSO4反应的离子方程式为
(2)“水解”步骤中,溶液中的CuCl43-在加入大量水稀释即可析出CuCl,原因是
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为
(4)“反应2”需加入的试剂X是
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻菲罗啉作指示剂,立刻用cmol·L-1的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为
您最近一年使用:0次
解题方法
2 . (NH4)2Fe(SO4)2·6H2O俗称摩尔盐(M=392g·mol-1)是分析化学中重要的标准物质,某研究小组拟采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)为原料制取摩尔盐,设计了如下流程:

(1)写出试剂X的化学式__________ 。
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式________ 。
(3)操作A为蒸发浓缩至_________ 、冷却结晶、过滤、洗涤、干燥。其中过滤操作可用如图装置进行,请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→_________ →d→c→关抽气泵。

a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
①产品中摩尔盐的纯度为__________ (用质量分数表示,保留4位有效数字)。
②若滴定过程中没有润洗滴定管,则会造成样品纯度______ (填“偏高”、“偏低”或“无影响”)

(1)写出试剂X的化学式
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式
(3)操作A为蒸发浓缩至

a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
| 滴定次数 | 0.1000mol·L-1Ce(SO4)2标准溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | |
| 1 | 0.10 | 20.12 |
| 2 | 0.12 | 20.10 |
| 3 | 0.05 | 21.65 |
②若滴定过程中没有润洗滴定管,则会造成样品纯度
您最近一年使用:0次
解题方法
3 .  是石油化学工业的一种重要催化剂,其中Ag起催化作用,
是石油化学工业的一种重要催化剂,其中Ag起催化作用,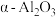 是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:
是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:

阅读上述实验流程,完成下列填空:
 加酸溶解应该选用装置
加酸溶解应该选用装置 图
图
______  选填a、b、
选填a、b、 .
.
 在实验操作
在实验操作 Ⅱ
Ⅱ ,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式 ______ .
 实验操作
实验操作 Ⅳ
Ⅳ 所需玻璃仪器为
所需玻璃仪器为 ______  填写三种
填写三种 .
.
 实验操作
实验操作 Ⅶ
Ⅶ 从
从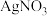 溶液获得
溶液获得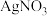 晶体需要进行的实验操作依次为:
晶体需要进行的实验操作依次为: ______  多选扣分
多选扣分 .
.
 蒸馏
蒸馏  蒸发
蒸发  灼烧
灼烧  冷却结晶
冷却结晶
 已知:
已知: ;
;

NO和 的混合气体的组成可表示为
的混合气体的组成可表示为 该混合气体通入NaOH溶液被完全吸收时,x的值为
该混合气体通入NaOH溶液被完全吸收时,x的值为 ______
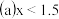
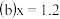

 已知
已知 中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 ______ 和 ______ .
 是石油化学工业的一种重要催化剂,其中Ag起催化作用,
是石油化学工业的一种重要催化剂,其中Ag起催化作用,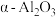 是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:
是载体且不溶于硝酸,该催化剂的回收实验如图1所示.其中的转化反应为:

阅读上述实验流程,完成下列填空:
 加酸溶解应该选用装置
加酸溶解应该选用装置 图
图
 选填a、b、
选填a、b、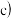 .
. 在实验操作
在实验操作 Ⅱ
Ⅱ ,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
,如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式  实验操作
实验操作 Ⅳ
Ⅳ 所需玻璃仪器为
所需玻璃仪器为  填写三种
填写三种 .
. 实验操作
实验操作 Ⅶ
Ⅶ 从
从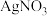 溶液获得
溶液获得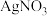 晶体需要进行的实验操作依次为:
晶体需要进行的实验操作依次为:  多选扣分
多选扣分 .
. 蒸馏
蒸馏 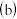 蒸发
蒸发 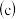 灼烧
灼烧 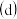 冷却结晶
冷却结晶  已知:
已知: ;
; 
NO和
 的混合气体的组成可表示为
的混合气体的组成可表示为 该混合气体通入NaOH溶液被完全吸收时,x的值为
该混合气体通入NaOH溶液被完全吸收时,x的值为 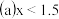
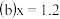

 已知
已知 中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
您最近一年使用:0次
解题方法
4 . 煅烧黄铁矿(主要成分为FeS2)所得的矿渣中含Fe2O3、SiO2、Al2O3、MgO等.用该矿渣可制备铁红(Fe2O3).完成下列填空:
(1)煅烧黄铁矿的化学方程式____ ,反应过程中被氧化的元素____ .
(2)矿渣中属于两性氧化物的是___ ,写出Fe2O3与稀硫酸反应的离子方程式__ .
(3)Al(OH)3的碱性比Mg(OH)2的碱性___ (选填“强”或“弱”);铝原子最外层电子排布式为____ .
(4)SiO2的熔点___ Fe2O3的熔点(填“大于”或“小于”),原因是__ .
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为______ (用表达式表示).
(1)煅烧黄铁矿的化学方程式
(2)矿渣中属于两性氧化物的是
(3)Al(OH)3的碱性比Mg(OH)2的碱性
(4)SiO2的熔点
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为
您最近一年使用:0次
解题方法
5 . 某厂以工业粗盐(含Ca2+、 Mg2+、SO 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
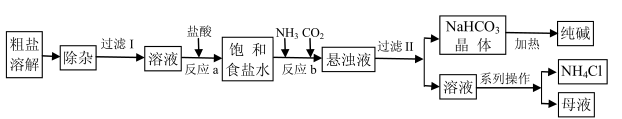
请回答下列问题:
(1)“除杂”步骤中需加入两种试剂,按加入顺序写出其名称____________ 。
(2)写出“反应a”的离子方程式___________ ;写出“反应b”的化学方程式___________ 。
(3)“过滤II”所得“溶液”中除NH 和Cl-外,还存在的阳离子有
和Cl-外,还存在的阳离子有___________ ,阴离子有___________ ;对该溶液进行的“系列操作”包括___________ 。
(4)上述工艺流程中可循环利用的物质有___________ 。
(5)工业纯碱的等级标准如下表所示:
称取某纯碱样品10.00g, 加入适量水溶解,再加入过量CaCl2溶液,充分反应后过滤、洗涤沉淀、干燥,称得沉淀质量为9.33g。请通过计算判断该纯碱样品的等级___________ 。
 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
请回答下列问题:
(1)“除杂”步骤中需加入两种试剂,按加入顺序写出其名称
(2)写出“反应a”的离子方程式
(3)“过滤II”所得“溶液”中除NH
 和Cl-外,还存在的阳离子有
和Cl-外,还存在的阳离子有(4)上述工艺流程中可循环利用的物质有
(5)工业纯碱的等级标准如下表所示:
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量1% | ≥99.2 | ≥98.8 | ≥98.0 |
称取某纯碱样品10.00g, 加入适量水溶解,再加入过量CaCl2溶液,充分反应后过滤、洗涤沉淀、干燥,称得沉淀质量为9.33g。请通过计算判断该纯碱样品的等级
您最近一年使用:0次
名校
解题方法
6 . 某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:

(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______ 、_______ 。
(2)写出加入氯水发生的离子反应方程式________________________________ 。
(3)写出加入过量氨水发生的离子反应方程式_______________________________ 。
(4)写出灼烧发生反应的化学方程式_______________________________ 。
(5)检验沉淀是否已经洗涤干净的操作是______________________________ 。
(6)下列操作可能使所配溶液浓度偏小的是__________ (填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________ 。

(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)写出加入氯水发生的离子反应方程式
(3)写出加入过量氨水发生的离子反应方程式
(4)写出灼烧发生反应的化学方程式
(5)检验沉淀是否已经洗涤干净的操作是
(6)下列操作可能使所配溶液浓度偏小的是
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是
您最近一年使用:0次
2019-12-30更新
|
136次组卷
|
2卷引用:西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期末考试化学试题
解题方法
7 . 过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。

(1)写出装置A中两种主要玻璃仪器的名称__________ 、_______ 。
(2)写出装置A中发生的离子方程式____________________________ 。
(3)装置B的作用是______________________________ 。
(4)写出装置C中发生反应的主要化学方程式:______________________________ 。
(5)装置D中 NaOH的作用是________________________________________ 。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________

(1)写出装置A中两种主要玻璃仪器的名称
(2)写出装置A中发生的离子方程式
(3)装置B的作用是
(4)写出装置C中发生反应的主要化学方程式:
(5)装置D中 NaOH的作用是
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
名校
8 . 聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。该过程中反应温度不宜过高,原因是_______ ;H2O2氧化Fe2+的离子方程式为________ 。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2mol·L−1K2Cr2O7溶液滴定至终点(滴定过程中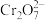 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将_______ (填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____________ 。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。该过程中反应温度不宜过高,原因是
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2mol·L−1K2Cr2O7溶液滴定至终点(滴定过程中
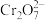 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将
②计算该样品中铁的质量分数(写出计算过程)
您最近一年使用:0次
名校
9 . Ⅰ.过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式_______________
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是______________
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%∼70%的过氧化氢溶液中,则该反应的化学方程式_______
Ⅱ. 某厂废水中含KCN,其浓度为650mg⋅L−1现用氯氧化法处理,发生如下反应(其中N均为−3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是____________________ .
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
___ KOCN+___ KOH+___ Cl2→_____ CO2+_____ N2+_____ KCl+______ H2O
(3)若将10m3含KCN的浓度为650mg⋅L−1的废水中KCN氧化除去,需要标准状况下的氯气的体积为______________________ L.
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%∼70%的过氧化氢溶液中,则该反应的化学方程式
Ⅱ. 某厂废水中含KCN,其浓度为650mg⋅L−1现用氯氧化法处理,发生如下反应(其中N均为−3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
(3)若将10m3含KCN的浓度为650mg⋅L−1的废水中KCN氧化除去,需要标准状况下的氯气的体积为
您最近一年使用:0次
名校
解题方法
10 . 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示,提示:SiO2不与HCl反应。

请回答下列问题:
(1)固体a的化学式为___ 。
(2)由图中Ⅱ所发生的离子方程式为___ 、___ 、___ 。Ⅲ所发生的离子方程式为___ 。
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__ 、冷却结晶、过滤洗涤。
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)__ L(保留一位小数)。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为___ 。

请回答下列问题:
(1)固体a的化学式为
(2)由图中Ⅱ所发生的离子方程式为
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为
您最近一年使用:0次



