解题方法
1 . 下列说法不正确 的是
A.向磷酸二氢钠溶液中加入过量澄清石灰水: |
B.用重铬酸钾法测定白酒中乙醇的含量: |
C.用碳酸钠溶液处理锅炉水垢中的硫酸钙: |
| D.制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 |
您最近一年使用:0次
名校
解题方法
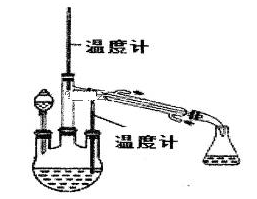
2 . 某纯碱样品中含有少量NaHCO3杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为m1g;
③准确称得m2g纯碱样品放入容器b中;
④打开仪器a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3g 。
⑥根据所得数据计算。试回答:
(1)仪器a的名称是___________
(2)装置B中发生反应的离子方程式_____________________________________ 。
(3)步骤⑤鼓入空气的目的是__________________________________________________ 。
(4)装置A中试剂X应选用______
A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl
(5)如果将a的硫酸换成浓度相同的盐酸,则会导致测定结果______ (“偏大”或“偏小”“不变”)
(6)如果除纯碱样品外,没有其他试剂,请设计一个也能测定纯碱样品中Na2CO3的质量分数的实验方案。主要步骤(不需要具体操作)_________________________ 有关化学方程式_____________________ 。

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为m1g;
③准确称得m2g纯碱样品放入容器b中;
④打开仪器a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3g 。
⑥根据所得数据计算。试回答:
(1)仪器a的名称是
(2)装置B中发生反应的离子方程式
(3)步骤⑤鼓入空气的目的是
(4)装置A中试剂X应选用
A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl
(5)如果将a的硫酸换成浓度相同的盐酸,则会导致测定结果
(6)如果除纯碱样品外,没有其他试剂,请设计一个也能测定纯碱样品中Na2CO3的质量分数的实验方案。主要步骤(不需要具体操作)
您最近一年使用:0次
2019-03-21更新
|
431次组卷
|
2卷引用:广东省深圳市高级中学2018-2019学年高一上学期期末考试化学试题
解题方法
3 . 高纯硝酸锶[Sr(NO3)2]用于制造电视显像管、光学玻璃,也用于医药等。
I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。
②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。
③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的Cr2O 还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)补充完整步骤①:__________ 。
(2)步骤③中H2C2O4·2H2O将过量的Cr2O 还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:
还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:__________ 。
(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:_____________ 。
(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内 H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比 20%的H2O2的利用率低的原因是_____________ 。

II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40 g SrO固体和10.16 g混合气体。
(5)计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)_________ 。
I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。
②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。
③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的Cr2O
 还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)补充完整步骤①:
(2)步骤③中H2C2O4·2H2O将过量的Cr2O
 还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:
还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:
(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内 H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比 20%的H2O2的利用率低的原因是

II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40 g SrO固体和10.16 g混合气体。
(5)计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)
您最近一年使用:0次
名校
4 . 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL1.0×10-4mol/L的KMnO4溶液。
(1)写出H2C2O4溶液与酸性KMnO4溶液反应的离子方程式__ 。
(2)计算:血液中含钙离子的浓度为__ mol/L。
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL1.0×10-4mol/L的KMnO4溶液。
(1)写出H2C2O4溶液与酸性KMnO4溶液反应的离子方程式
(2)计算:血液中含钙离子的浓度为
您最近一年使用:0次
名校
5 . 碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下,(已知TeO2微溶于水,易溶于强酸和强碱),下列有关说法不正确的是


| A.将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率 |
| B.“碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O |
| C.“沉碲”时为使碲元素沉淀充分,应加入过量的硫酸 |
| D.若提取过程碲元素的回收率为90%,则处理1kg这种阳极泥最少需通入标准状况下SO2 20.16L |
您最近一年使用:0次
2019-02-05更新
|
414次组卷
|
8卷引用:浙江省“七彩阳光”联盟2018届高三上学期期中考试化学试题
浙江省“七彩阳光”联盟2018届高三上学期期中考试化学试题浙江省诸暨中学2017-2018学年高三上学期第二阶段考化学试题【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题浙江省杭州学军中学2021届高三上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高三上】【期中】【HD-LP423】【化学】(已下线)【浙江新东方】120四川省内江市第六中学2021-2022学年高一下学期期中考试化学试题第四章 非金属及其化合物 第25讲 非金属及其化合物知识落实与拓展
2019高三上·全国·专题练习
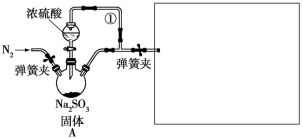
6 . 某同学设计了如图装置用于制取SO2和验证SO2的漂白性、水溶液的酸性、还原性。
试回答下列问题:
(1)装置A中发生反应的化学方程式为______________ 。
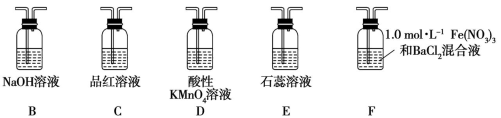
(2)在框图内选择合适装置(从B~E中选择)依次验证SO2的漂白性、水溶液的酸性、还原性,上述各装置按气流从左到右方向连接顺序为A→_______ (填装置的字母编号)。
(3)装置D中发生反应的离子方程式是______________ 。
(4)实验前须鼓入N2,目的是____________ ,简述此操作的必要性:____ 。
(5)已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,若将SO2气体通入装置F,装置F中产生了白色沉淀,其成分是______________ (填化学式),分析F中产生白色沉淀的可能原因及观察到的其他现象:______ 。
(6)实验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00 g产品,配成100 mL溶液,移取25.00 mL溶液,用0.200 0 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4溶液20.00 mL,其中KMnO4→Mn2+。产品中Na2SO3的质量分数为_______ 。
试回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)在框图内选择合适装置(从B~E中选择)依次验证SO2的漂白性、水溶液的酸性、还原性,上述各装置按气流从左到右方向连接顺序为A→
(3)装置D中发生反应的离子方程式是
(4)实验前须鼓入N2,目的是
(5)已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,若将SO2气体通入装置F,装置F中产生了白色沉淀,其成分是
(6)实验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00 g产品,配成100 mL溶液,移取25.00 mL溶液,用0.200 0 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4溶液20.00 mL,其中KMnO4→Mn2+。产品中Na2SO3的质量分数为
您最近一年使用:0次
名校
7 . 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
步骤1:制备NaClO溶液。已知:3NaClO NaCl+NaClO3
NaCl+NaClO3
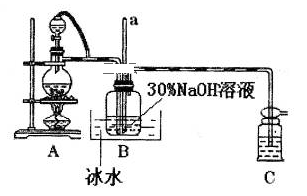
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_______ (填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是__________ ;若装置C中出现堵塞,玻璃管a中的现象为_______________ ;B中用冰水浴控制温度在30℃以下,其主要目的是______________ 。
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)。
(3)分液漏斗中的溶液是___________ (填“A”或“B”);
A.NaOH和NaClO混合溶液 B.CO(NH2)2溶液
步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为_______________ 。
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为_______________________________________ ;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为__________ 。(保留三位有效数字)
步骤1:制备NaClO溶液。已知:3NaClO
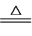 NaCl+NaClO3
NaCl+NaClO3
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)。
(3)分液漏斗中的溶液是
A.NaOH和NaClO混合溶液 B.CO(NH2)2溶液

步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为
您最近一年使用:0次
2019-01-27更新
|
167次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
解题方法
8 . 硫酸亚铁晶体(FeSO4•7H2O)在医药上做补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如图所示:

请回答下列问题:
(1)步骤②中反应的离子方程式:___________ 。
(2)步骤③中反应的离子方程式:___________ 。
(3)步骤④中一系列的操作步骤;过滤、洗涤、灼烧、___________ 、称量。
(4)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为___________ g。(用含a的代数式表示)

请回答下列问题:
(1)步骤②中反应的离子方程式:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列的操作步骤;过滤、洗涤、灼烧、
(4)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次
9 . 已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________ (用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________ ,这种混合气体的密度是同温同压下氧气密度的_____ 倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________ mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
 CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:(1)A物质可以导致酸雨的形成。则A应该属于
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是
您最近一年使用:0次
2018-12-19更新
|
114次组卷
|
3卷引用:江西省上饶市“山江湖”协作体2018-2019学年高一上学期第三次月考化学试题
江西省上饶市“山江湖”协作体2018-2019学年高一上学期第三次月考化学试题江西省南昌市新建县第一中学2019-2020学年高一上学期第二次月考化学试题(已下线)【南昌新东方】2019 新建一中高一上第二次月考
10 . 工业上可以用废铁屑制备活性Fe3O4,流程如下图:

(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):

操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
① 操作Ⅱ中“……”的内容是______________ ,烧杯中的现象是_________________ ,并有气泡产生。相应的方程式是________________ 、________________ 。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是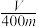 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________ 。

(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是
(2)在合成池里生成Fe3O4的离子方程式为
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):

操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
① 操作Ⅱ中“……”的内容是
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是
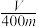 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是
您最近一年使用:0次



