名校
1 . 向含有0.01 mol Cu,amol Cu2O、bmol CuO的混合物中滴加6 mol/L的稀硝酸溶液至10 mL时,固体恰好完全溶解,得到标准状况下224 mL气体(纯净物)。下列说法不正确的是
| A.反应过程中转移0.03 mol电子 | B.a∶b=1∶1 |
| C.等量上述稀硝酸中最多能溶解0.84 g Fe | D.被还原的硝酸为0.01 mol |
您最近一年使用:0次
2 . 已知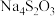 和
和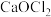 均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法
均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法不正确 的是
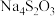 和
和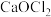 均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法
均属于混盐(由一种阳离子与两种酸根阴离子组成的盐)。下列说法A.1mo 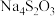 固体中共含有6mol离子 固体中共含有6mol离子 |
B.向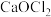 中加入足量稀硫酸会有 中加入足量稀硫酸会有 产生,被氧化与被还原的原子数相等 产生,被氧化与被还原的原子数相等 |
C.向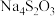 中加入足量稀硫酸时发生反应: 中加入足量稀硫酸时发生反应: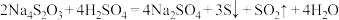 。 。 |
D. 是含有极性键的非极性分子 是含有极性键的非极性分子 |
您最近一年使用:0次
名校
解题方法
3 . 硝酸工业生产中常用纯碱溶液吸收排出的氮氧化物废气,废气中只含有NO、 两种气体。将一定量废气通入到足量的
两种气体。将一定量废气通入到足量的 溶液中被完全吸收,溶液中生成的
溶液中被完全吸收,溶液中生成的 、
、 两种离子的物质的量与废气中
两种离子的物质的量与废气中 的物质的量分数
的物质的量分数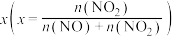 变化关系可用如图所示。
变化关系可用如图所示。
①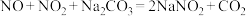 ;
;
②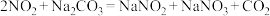 。
。
下列说法不正确的是
 两种气体。将一定量废气通入到足量的
两种气体。将一定量废气通入到足量的 溶液中被完全吸收,溶液中生成的
溶液中被完全吸收,溶液中生成的 、
、 两种离子的物质的量与废气中
两种离子的物质的量与废气中 的物质的量分数
的物质的量分数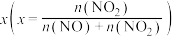 变化关系可用如图所示。
变化关系可用如图所示。
①
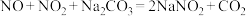 ;
;②
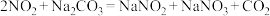 。
。下列说法不正确的是
A.图中线段b表示 离子 离子 |
B.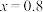 时,反应中可收集到标准状况下44.8L 时,反应中可收集到标准状况下44.8L  |
C.随x值增大,溶液中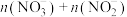 不变 不变 |
D.若测得所得溶液中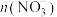 为0.5mol,则x值为0.75 为0.5mol,则x值为0.75 |
您最近一年使用:0次
名校
解题方法
4 . 一种利用炼锌渣(主要含 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示: 。
。
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,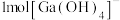 中含有
中含有 键的数目为
键的数目为___________ 。
(2)黄钠铁矾的化学式为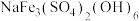 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。
①“沉铁”时生成黄钠铁矾的离子方程式为___________ 。
②不采用调节 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成 而损失;
而损失;___________ (答2点)。
(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量 粉,加入铜粉的目的是
粉,加入铜粉的目的是___________ 。
(4) 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是___________ 。 。已知:室温时,
。已知:室温时,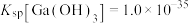 ,
,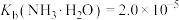 ,
,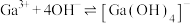
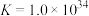 。反应
。反应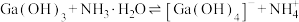 的平衡常数为
的平衡常数为___________ 。
(6)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含___________ 个 ,
,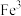 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
 。
。(1)基态
 的价层电子排布式为
的价层电子排布式为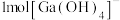 中含有
中含有 键的数目为
键的数目为(2)黄钠铁矾的化学式为
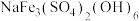 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。①“沉铁”时生成黄钠铁矾的离子方程式为
②不采用调节
 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成 而损失;
而损失;(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量
 粉,加入铜粉的目的是
粉,加入铜粉的目的是(4)
 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是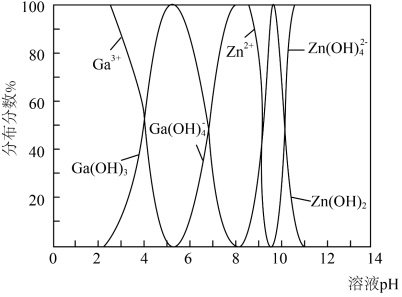
 。已知:室温时,
。已知:室温时,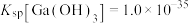 ,
,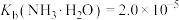 ,
,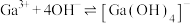
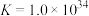 。反应
。反应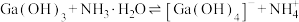 的平衡常数为
的平衡常数为(6)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含 ,
,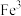 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。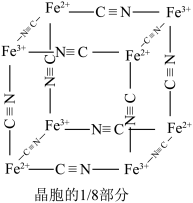
您最近一年使用:0次
名校
5 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积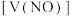 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
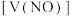 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
| A.a点时,100mL稀硝酸中溶解了Fe粉5.6g |
B.稀硝酸的浓度为 |
| C.加入稀硝酸的体积从300mL至400mL,期间收集产生的NO物质的量约为0.0083mol |
D.b点对应的溶液中可能含有的金属阳离子为 、 、 和 和 |
您最近一年使用:0次
6 . 工业上利用锌焙砂(主要成分为  ,含有少量
,含有少量 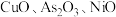 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
(1)用足量 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是___________ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)“浸出”时 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为___________
(3)“除重金属”时,加入 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是___________ 和  。
。
(4)“蒸氨”时会出现白色固体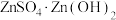 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为___________ 。
(6)煅烧”步骤中,在一定温度下,煅烧 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为___________  (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。
(7)该流程中可循环利用的物质有___________ (答出任意 2 种即可)
 ,含有少量
,含有少量 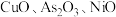 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
(1)用足量
 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为(3)“除重金属”时,加入
 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
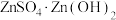 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为(6)煅烧”步骤中,在一定温度下,煅烧
 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为 (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。(7)该流程中可循环利用的物质有
您最近一年使用:0次
7 . 碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是___________ 。
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为___________ 。___________ 。其他条件不变,溶液中铜元素的质量随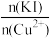 变化情况如图所示,当
变化情况如图所示,当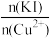 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是___________ 。 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是___________ 。
(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,___________ 。(实验中须使用的试剂和仪器有:SO2、I2、0.1 mol·L−1 NaOH、乙醇、真空干燥箱)。
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为___________ (保留一位小数)。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为
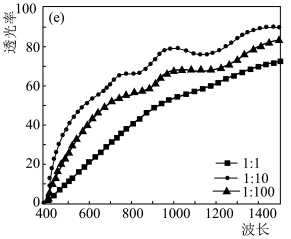

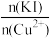 变化情况如图所示,当
变化情况如图所示,当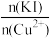 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是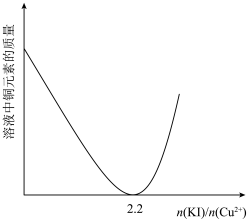
 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为

您最近一年使用:0次
名校
8 . 硫化钡(BaS)是一种用于制取含钡化合物和含硫化合物的化工原料。一种以BaS为原料生产氢氧化钡并获得某种副产品X和硫代硫酸钠( )的工艺流程如下:
)的工艺流程如下:
Ⅰ. 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。
Ⅱ. 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。
回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石( ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入 可发生反应生成
可发生反应生成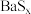 和
和 。下图是
。下图是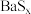 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中_______ (填“甲”或“乙”)代表 的溶解度曲线。
的溶解度曲线。 中的x可变,当
中的x可变,当 时,
时,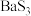 晶体的晶胞如下:
晶体的晶胞如下: ,则
,则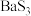 的密度为
的密度为_______  (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。
(4) 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有_______ (填标号)。
a.NaClO溶液 b.稀 溶液 c.KI溶液
溶液 c.KI溶液
(5)往母液A中加入 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为_______ 。已知温度较低时, 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是_______ 。
(6)在碱性条件下往母液B中通入 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:_______ 。
 )的工艺流程如下:
)的工艺流程如下: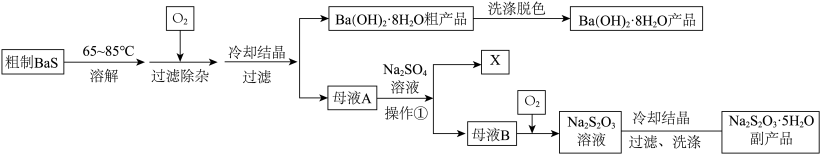
Ⅰ.
 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。Ⅱ.
 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石(
 ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入
 可发生反应生成
可发生反应生成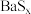 和
和 。下图是
。下图是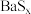 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中 的溶解度曲线。
的溶解度曲线。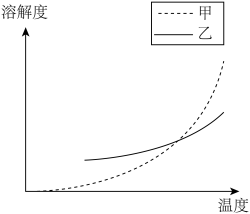
 中的x可变,当
中的x可变,当 时,
时,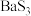 晶体的晶胞如下:
晶体的晶胞如下:
 ,则
,则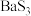 的密度为
的密度为 (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。(4)
 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有a.NaClO溶液 b.稀
 溶液 c.KI溶液
溶液 c.KI溶液(5)往母液A中加入
 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是(6)在碱性条件下往母液B中通入
 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:
您最近一年使用:0次
名校
9 . 利用含锌废水制备ZnCO3·2Zn(OH)2的工艺流程如图,下列有关说法正确的是
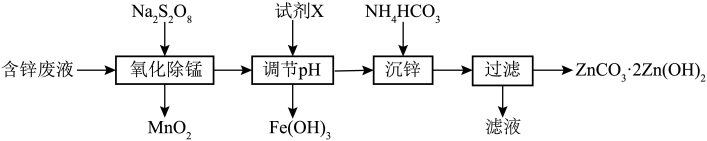
已知:①
②Zn2+ 可以与氨水反应生成[ Zn(NH3)4 ]2+

已知:①
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| Ksp | 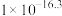 | 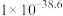 | 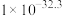 | 1.2 x 10-17 |
| A.Na2S2O8中硫元素的化合价为+7价 |
| B.氧化除锰步骤中氧化剂和还原剂的物质的量之比为2:1 |
C.沉锌时发生反应的离子方程式主要是: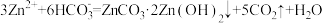 |
| D.调节pH值除铁时,应选用的试剂X为氨水,调节pH值应大于9,以便将铁完全沉淀。 |
您最近一年使用:0次
名校
10 . 以绿茶为主要原料合成生物炭负载纳米铁(CT-FeNPs/BC)
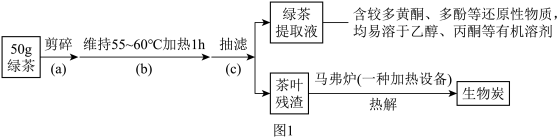
步骤1:绿茶提取液及生物炭的制备。按如图1流程实验:
 溶液和生物炭。
溶液和生物炭。
②通一段时间 后,将绿茶提取液以2mL·
后,将绿茶提取液以2mL·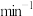 的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。
的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。
③离心分离,依次用乙醇和蒸馏水洗涤,真空干燥,产品密封备用。
回答下列问题:
(1)操作(b)中,应采用___________ 进行加热。
(2)图2中,盛装绿茶提取液的仪器名称为___________ ,加入绿茶提取液的目的是___________ 。
(3)离心分离后,用乙醇洗涤的作用是___________ 。
(4)判断产品洗涤干净的实验操作为___________ 。
(5)GT-FeNPs/BC可高效去除含铬强酸性废水中的六价铬(以 表示),反应过程如图3。
表示),反应过程如图3。 和
和 共同生成沉淀
共同生成沉淀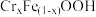 的离子方程式:
的离子方程式:___________ 。
②研究表明,GT-FeNPs/BC和 均可用于降解含
均可用于降解含 的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:
的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:
结合图3分析,实验3降解 效率显著增大的原因是
效率显著增大的原因是___________ 。
步骤1:绿茶提取液及生物炭的制备。按如图1流程实验:


 溶液和生物炭。
溶液和生物炭。②通一段时间
 后,将绿茶提取液以2mL·
后,将绿茶提取液以2mL·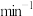 的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。
的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。③离心分离,依次用乙醇和蒸馏水洗涤,真空干燥,产品密封备用。
回答下列问题:
(1)操作(b)中,应采用
(2)图2中,盛装绿茶提取液的仪器名称为
(3)离心分离后,用乙醇洗涤的作用是
(4)判断产品洗涤干净的实验操作为
(5)GT-FeNPs/BC可高效去除含铬强酸性废水中的六价铬(以
 表示),反应过程如图3。
表示),反应过程如图3。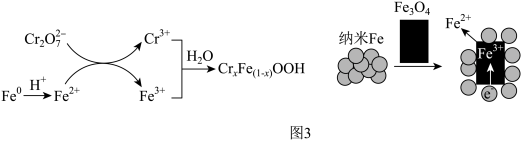
 和
和 共同生成沉淀
共同生成沉淀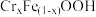 的离子方程式:
的离子方程式:②研究表明,GT-FeNPs/BC和
 均可用于降解含
均可用于降解含 的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:
的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:| 实验编号 | GT-FeNPs/BC(g/L) |  (g/L) (g/L) |  实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
 效率显著增大的原因是
效率显著增大的原因是
您最近一年使用:0次



