名校
解题方法
1 . 高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: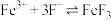
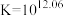

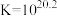
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的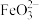 。此过程的反应为
。此过程的反应为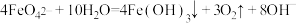 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中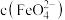 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
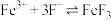
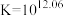

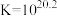
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的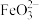 。此过程的反应为
。此过程的反应为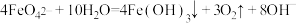 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
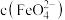 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次
2023-05-07更新
|
575次组卷
|
2卷引用:北京市昌平区2023届高三下学期第二次统一练习化学试题
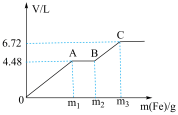
2 . 向200mL稀 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中 的物质的量浓度为1 mol/L 的物质的量浓度为1 mol/L |
| B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜 |
C.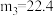 |
D.每一阶段反应转移电子数目之比为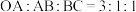 |
您最近一年使用:0次
名校
3 . 某小组同学制备碘酸盐( )并探究其性质。
)并探究其性质。
资料:① 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。
②碘酸钙 [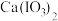 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。
③ 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。
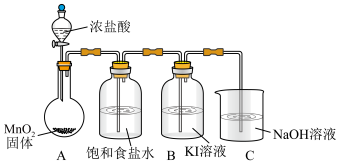
实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。
(1)A装置发生的化学方程式为___________ 。
(2)C装置发生的离子方程式为___________ 。
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为___________ 。
原因二:___________ (填化学式)在酸性条件下将溶液中的 氧化。
氧化。
②为了进一步证明在酸性条件下 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
ⅱ.向无色溶液X,加入与(3)等量的盐酸和 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。
ⅲ.取少量洗涤后的沉淀Y加入稀 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:___________ 。
b.由实验ⅲ和ⅳ得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象___________ 。
(4)根据实验ⅲ得出:氧化性
___________  (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(5)查阅资料发现,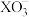 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因___________ 。
 )并探究其性质。
)并探究其性质。资料:①
 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。②碘酸钙 [
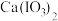 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。③
 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入
 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。(1)A装置发生的化学方程式为
(2)C装置发生的离子方程式为
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和
 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中
 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为原因二:
 氧化。
氧化。②为了进一步证明在酸性条件下
 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量
 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。ⅱ.向无色溶液X,加入与(3)等量的盐酸和
 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。ⅲ.取少量洗涤后的沉淀Y加入稀
 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。ⅳ.……
a.由实验ⅰ、ⅱ得出结论:
b.由实验ⅲ和ⅳ得出结论:在酸性条件下
 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象(4)根据实验ⅲ得出:氧化性

 (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(5)查阅资料发现,
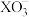 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
您最近一年使用:0次
2023-05-01更新
|
817次组卷
|
3卷引用:北京市北京师范大学附属实验中学2022-2023学年高一下学期期中考试化学试题
解题方法
4 . 某小组探究铜与浓硝酸的反应。
【实验】
(1)铜与浓硝酸反应的化学方程式是_______ ,氢氧化钠溶液的作用是_______ 。
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约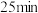 后溶液转为蓝色。
后溶液转为蓝色。
实验1-2:取 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色
(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是_______ 。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;
ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素 具有温和的抗氧化性;
具有温和的抗氧化性;
iv.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。
其原理为:
第一步: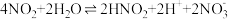
第二步: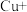 …
…
第三步:
【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
(3)补全iv中原理的第二步反应:_______ 。
(4)实验2-3中没有绿色出现的原因是_______ 。
(5)因为发生化学反应:_______ 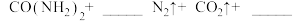 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。
(6)解释实验1-1和1-2的现象差异原因_______ 。
【实验】
| 实验装置(夹特仪器略) | 实验现象 |
 | 铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色 |
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取
 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约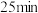 后溶液转为蓝色。
后溶液转为蓝色。实验1-2:取
 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素
 具有温和的抗氧化性;
具有温和的抗氧化性;iv.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
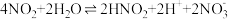
第二步:
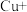 …
…第三步:

【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
| 编号 | 浓硝酸 | 蒸馏水/滴 | 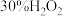 /滴 /滴 |  尿素溶液/滴 尿素溶液/滴 | 现象 |
| 2-1 | 1 | 0 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-2 | 1 | 3 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-3 | 1 | 0 | 3 | 0 | 反应较慢,溶液为蓝色,没有绿色出现 |
| 2-4 | 1 | 0 | 0 | 3 | 反应较慢,溶液为蓝色,没有绿色出现 |
(4)实验2-3中没有绿色出现的原因是
(5)因为发生化学反应:
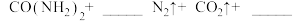 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。(6)解释实验1-1和1-2的现象差异原因
您最近一年使用:0次
解题方法
5 . 将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 的体积和剩余金属的质量如表所示(设
的体积和剩余金属的质量如表所示(设 的还原产物只有
的还原产物只有 ):
):
下列说法错误的是
 的体积和剩余金属的质量如表所示(设
的体积和剩余金属的质量如表所示(设 的还原产物只有
的还原产物只有 ):
):| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
稀硝酸的体积/ | 50 | 100 | 150 | 175 |
| 剩余金属的质量/g | 9.0 | 4.8 | 0 | 0 |
 的体积(标准状况)/ 的体积(标准状况)/ | 1120 | 2240 | 3360 | V |
A.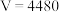 |
B.每等份混合物的质量为 |
C.稀硝酸的物质的量的浓度为 |
D.实验Ⅰ中发生反应的化学方程式为 |
您最近一年使用:0次
2023-04-27更新
|
743次组卷
|
2卷引用:河北省邢台市2022-2023学年高一下学期期中考试化学试题
名校
解题方法
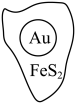
6 . 抗原检测盒中T线处使用的是胶体金(Au)标记物。一种从被 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:
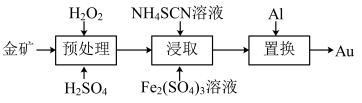
(1)①“预处理”时,用 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式______ 。
②研究发现:在 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
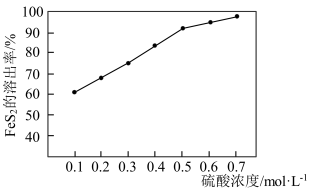
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是________ 。
(2)“置换”时需维持无氧环境,其主要原因是_________ 。
(3)测定样品中 的含量:准确称取
的含量:准确称取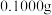 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸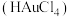 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量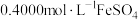 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用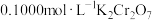 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。
已知: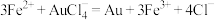

计算样品中金的质量分数(写出计算过程)_____________ 。
 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:

(1)①“预处理”时,用
 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式②研究发现:在
 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是
(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中
 的含量:准确称取
的含量:准确称取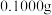 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸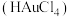 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量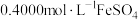 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用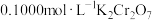 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。已知:
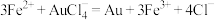

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2023-04-25更新
|
917次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 探究硫及其化合物的性质,下列方案设计、现象和结论中有不正确的是
实验方案 | 现象 | 结论 | |
A | 在过硫化钠(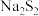 )中加入稀盐酸 )中加入稀盐酸 | 产生淡黄色沉淀和臭鸡蛋气味的气体。 | 发生歧化反应: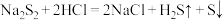 |
B | 已知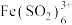 呈红棕色,将 呈红棕色,将 气体通入 气体通入 溶液中 溶液中 | 溶液先变为红棕色,过一段时间又变成浅绿色。 |  与 与 络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大。 络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大。 |
C | 燃着的镁条插入盛有 的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量 的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量 溶液。 溶液。 | 剧烈燃烧,集气瓶口有淡黄色固体附着,集气瓶底有白色固体生成。试管中没有产生黑色沉淀 | 镁能在 中燃烧: 中燃烧: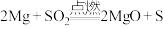 |
D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液,观察现象 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-22更新
|
1840次组卷
|
6卷引用:浙江省天域全国名校协作体2022-2023学年高三下学期4月阶段性联考化学试题
浙江省天域全国名校协作体2022-2023学年高三下学期4月阶段性联考化学试题重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市第一中学2023-2024学年高三上学期月考卷(三)化学试题江西省抚州市乐安县第二中学2023-2024学年高三上学期11月期中化学试题2024年山东省潍坊市高三下学期高考模拟训练调研试题(二)
名校
解题方法
8 . 将1.52 g铜镁合金完全溶解于50 mL密度为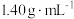 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体0.05 mol,向反应后的溶液中加入
的混合气体0.05 mol,向反应后的溶液中加入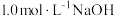 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
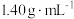 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体0.05 mol,向反应后的溶液中加入
的混合气体0.05 mol,向反应后的溶液中加入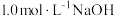 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是| A.该合金中铜与镁的物质的量之比是2:1 |
B.该浓硝酸中 的物质的量浓度是 的物质的量浓度是 |
C. 和 和 的混合气体中, 的混合气体中, 的体积分数是20% 的体积分数是20% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是660 mL |
您最近一年使用:0次
9 . 电镀废水中含有的络合态镍(Ⅱ)和甘氨酸铬(Ⅲ)等重金属污染已成为世界性环境问题。常用的处理方法是臭氧法和纳米零价铁法。
I.臭氧法
(1)在废水中通入 ,在紫外光(UV)照射下产生羟基自由基(·OH),氧化分解络合态Ni(Ⅱ)使镍离子游离到废水中,部分机理如下:
,在紫外光(UV)照射下产生羟基自由基(·OH),氧化分解络合态Ni(Ⅱ)使镍离子游离到废水中,部分机理如下:
ⅰ.
ⅱ.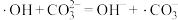
ⅲ.
①写出产生·OH的化学方程式:__________ 。
②加入一定量的 有利于提高氧化效果,原因是
有利于提高氧化效果,原因是____________ 。
Ⅱ.纳米零价铁法
(2)制备纳米零价铁。
将 和
和 溶液在乙醇和水的混合溶液中混合搅拌(
溶液在乙醇和水的混合溶液中混合搅拌( 氛围),充分反应得到纳米零价铁、
氛围),充分反应得到纳米零价铁、 、HCl、NaCl和
、HCl、NaCl和 。写出反应的化学方程式
。写出反应的化学方程式_______________ 。
(3)纳米零价铁处理甘氨酸铬。
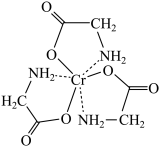
①甘氨酸铬(结构简式如图)分子中与铬配位的原子为_________ 。
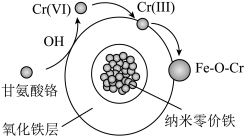
②研究表明:纳米零价铁对有机物的降解通常是产生液相·OH对有机物官能团进行断键,使有机络合态Cr(Ⅲ)被释放到溶液中,同时氧化成无机Cr(Ⅵ)。纳米零价铁对甘氨酸铬的去除机理如图所示:
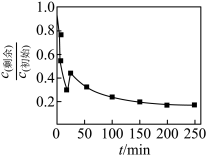
对初始铬浓度为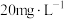 的甘氨酸铬去除率进行研究,总铬去除率随时间的变化如图所示,其可能的原因是
的甘氨酸铬去除率进行研究,总铬去除率随时间的变化如图所示,其可能的原因是____________ 。
I.臭氧法
(1)在废水中通入
 ,在紫外光(UV)照射下产生羟基自由基(·OH),氧化分解络合态Ni(Ⅱ)使镍离子游离到废水中,部分机理如下:
,在紫外光(UV)照射下产生羟基自由基(·OH),氧化分解络合态Ni(Ⅱ)使镍离子游离到废水中,部分机理如下:ⅰ.

ⅱ.
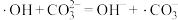
ⅲ.

①写出产生·OH的化学方程式:
②加入一定量的
 有利于提高氧化效果,原因是
有利于提高氧化效果,原因是Ⅱ.纳米零价铁法
(2)制备纳米零价铁。
将
 和
和 溶液在乙醇和水的混合溶液中混合搅拌(
溶液在乙醇和水的混合溶液中混合搅拌( 氛围),充分反应得到纳米零价铁、
氛围),充分反应得到纳米零价铁、 、HCl、NaCl和
、HCl、NaCl和 。写出反应的化学方程式
。写出反应的化学方程式(3)纳米零价铁处理甘氨酸铬。
①甘氨酸铬(结构简式如图)分子中与铬配位的原子为

②研究表明:纳米零价铁对有机物的降解通常是产生液相·OH对有机物官能团进行断键,使有机络合态Cr(Ⅲ)被释放到溶液中,同时氧化成无机Cr(Ⅵ)。纳米零价铁对甘氨酸铬的去除机理如图所示:

对初始铬浓度为
 的甘氨酸铬去除率进行研究,总铬去除率随时间的变化如图所示,其可能的原因是
的甘氨酸铬去除率进行研究,总铬去除率随时间的变化如图所示,其可能的原因是
您最近一年使用:0次
名校
解题方法
10 . 回收利用含硫化合物有利于节约资源、保护环境。
(1)一种由含 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺( )。该工艺中涉及反应为:
)。该工艺中涉及反应为:
反应1:

反应2: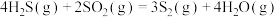
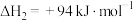
反应3:
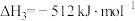
①反应 的△H=
的△H=_______ 。
②如果上述反应均能完全进行,为提高硫磺的产率,该工艺中需要控制的是_______ 。
(2)一种以 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下:写出转化中由
的物质转化关系如下:写出转化中由 制
制 的化学反应方程式:
的化学反应方程式:_______ 。
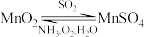
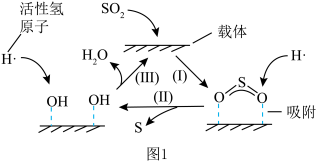
(3)一种以 为催化剂载体、
为催化剂载体、 为催化剂的
为催化剂的 还原烟气中
还原烟气中 制S的反应机理如图1和如图2所示:
制S的反应机理如图1和如图2所示:
①如图1中所示转化可以描述为_______ 。
②如图2中X的电子式为_______ 。
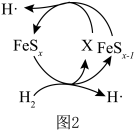
③其他条件一定,改变起始时 与
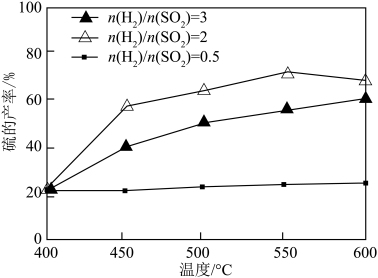
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如图所示。500℃时,
比值的关系如图所示。500℃时,  比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是_______ 。
(1)一种由含
 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺( )。该工艺中涉及反应为:
)。该工艺中涉及反应为:反应1:


反应2:
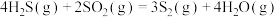
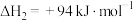
反应3:

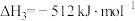
①反应
 的△H=
的△H=②如果上述反应均能完全进行,为提高硫磺的产率,该工艺中需要控制的是
(2)一种以
 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下:写出转化中由
的物质转化关系如下:写出转化中由 制
制 的化学反应方程式:
的化学反应方程式: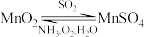
(3)一种以
 为催化剂载体、
为催化剂载体、 为催化剂的
为催化剂的 还原烟气中
还原烟气中 制S的反应机理如图1和如图2所示:
制S的反应机理如图1和如图2所示:①如图1中所示转化可以描述为

②如图2中X的电子式为

③其他条件一定,改变起始时
 与
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如图所示。500℃时,
比值的关系如图所示。500℃时,  比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是
您最近一年使用:0次
2023-04-16更新
|
522次组卷
|
2卷引用:江苏省南通市通州区2022-2023学年高三下学期4月月考化学试题



