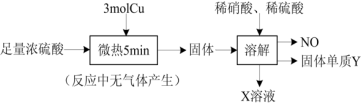
1 . 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测所得固体中含有 和白色物质X,下列说法正确的是
和白色物质X,下列说法正确的是
 和白色物质X,下列说法正确的是
和白色物质X,下列说法正确的是
A.白色物质X为 ,体现了浓硫酸具有吸水性 ,体现了浓硫酸具有吸水性 |
| B.NO和Y均为还原产物 |
| C.3mol Cu参与反应,转移了6mol电子 |
| D.若稀硫酸足量,在溶解的环节中至少需要0.8mol的稀硝酸 |
您最近一年使用:0次
2022-12-03更新
|
976次组卷
|
3卷引用: 山东省济宁市兖州区2022-2023学年高三上学期期中考试化学试题
名校
解题方法
2 . 白磷(P4)有毒,实验时若皮肤接触到白磷,应立即用稀CuSO4溶液清洗,发生两个反应:
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
| A.在反应①和②中,P4只作还原剂 |
| B.反应①中氧化产物与还原产物的个数之比为5∶2 |
| C.皮肤接触到白磷,用稀CuSO4溶液清洗后,应再使用NaOH溶液清洗 |
| D.若P4反应完全且转化为H3PO4的转化率是80%,理论上反应①和②消耗P4的个数之比为14∶11 |
您最近一年使用:0次
2022-11-09更新
|
1305次组卷
|
4卷引用:重庆实验外国语学校2022-2023学年高一上学期期中检测化学试题
2022高二上·安徽阜阳·竞赛
解题方法
3 . 化学一直都在发展……
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO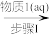 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O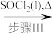 Cu(NO3)2(无水)
Cu(NO3)2(无水)
已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为_______ (填写化学式),步骤III中加入SOCl2的作用是_______ ,写出步骤III发生的化学反应的化学方程式_______ 。
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了_______ (填反应类型),其反应的化学方程式为_______ 。
②现如今化学家们发明了另一种制备方法:
Cu(s) Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4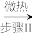 Cu(NO3)2
Cu(NO3)2
已知:在液态N2O4中存在一下自耦电离平衡:N2O4 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
(3)试写出步骤I与步骤II的方程式:步骤I_______ ;步骤II_______ 。
(4)该反应的优点(写出一条即可):_______ 。
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO
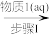 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O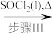 Cu(NO3)2(无水)
Cu(NO3)2(无水)已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了
②现如今化学家们发明了另一种制备方法:
Cu(s)
 Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4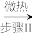 Cu(NO3)2
Cu(NO3)2已知:在液态N2O4中存在一下自耦电离平衡:N2O4
 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分(3)试写出步骤I与步骤II的方程式:步骤I
(4)该反应的优点(写出一条即可):
您最近一年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
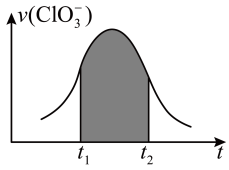
4 . 已知氯酸钾和和亚硫酸氢钾可以发生氧化还原反应(无污染性气体产生),且反应中被氧化被还原的元素个数都只有一个。若该反应的反应速率会随着c(H+)的提升而加快,下图为ClO 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
| A.反应进行一段时间后速率下降可能是因为c(OH-)的浓度下降导致。 |
| B.纵坐标为v(H+)的v-t曲线在通过平移后可与图中图象完全重合。 |
C.图中阴影部分的面积表示t1~t2时间内ClO 的物质的量的减少量。 的物质的量的减少量。 |
| D.系数为最简整数比时,每摩尔反应转移6mol e-并产生3mol质子。 |
您最近一年使用:0次
名校
解题方法
5 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中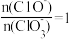 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2070次组卷
|
12卷引用:江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题
江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
6 . 铬酸铅俗称铬黄,是一种难溶于水的黄色固体,也是一种重要的黄色颜料,常用作橡胶、油墨、水彩、色纸等的着色剂。工业上用草酸泥渣(主要含草酸铅、硫酸铅)和铬矿渣(主要成分为 ,含有少量的
,含有少量的 )为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
)为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
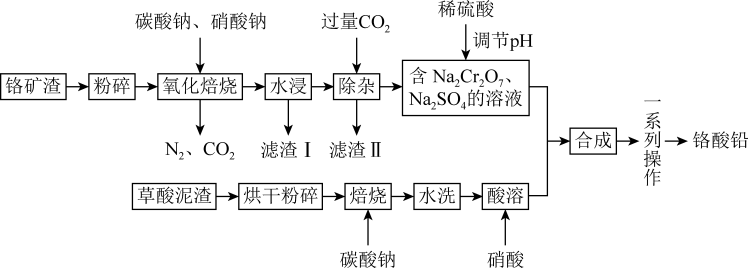
回答下列问题:
(1)将铬矿渣“粉碎"”的目的是_______ ;草酸泥渣“焙烧”后“水洗”的作用是_______ 。
(2)“滤渣Ⅱ”的主要成分是_______ (填化学式)。
(3)“氧化焙烧”时, 被氧化的反应的化学方程式为
被氧化的反应的化学方程式为_______ 。
(4)“一系列操作”包括_______ 、粉碎。
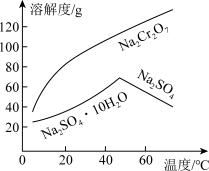
(5)为了使产品更纯,需将“含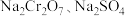 的溶液”分离提纯,依据如图所示的溶解度信息,“含
的溶液”分离提纯,依据如图所示的溶解度信息,“含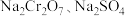 的溶液”分离提纯的操作是
的溶液”分离提纯的操作是_______ 。分离提纯后得到的固体的化学式为_______ 。
(6)“焙烧”时加入碳酸钠是为了将硫酸铅转化为氧化铅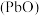 ,同时放出二氧化碳,该转化过程的化学方程式为
,同时放出二氧化碳,该转化过程的化学方程式为_______ 。
 ,含有少量的
,含有少量的 )为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
)为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
回答下列问题:
(1)将铬矿渣“粉碎"”的目的是
(2)“滤渣Ⅱ”的主要成分是
(3)“氧化焙烧”时,
 被氧化的反应的化学方程式为
被氧化的反应的化学方程式为(4)“一系列操作”包括
(5)为了使产品更纯,需将“含
 的溶液”分离提纯,依据如图所示的溶解度信息,“含
的溶液”分离提纯,依据如图所示的溶解度信息,“含 的溶液”分离提纯的操作是
的溶液”分离提纯的操作是
(6)“焙烧”时加入碳酸钠是为了将硫酸铅转化为氧化铅
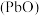 ,同时放出二氧化碳,该转化过程的化学方程式为
,同时放出二氧化碳,该转化过程的化学方程式为
您最近一年使用:0次
7 . 书写方程式
(1)硫酸铝和硅酸钠溶液反应的离子方程式_______ 。
(2)酚醛树脂的合成_______ 。
(3)用重铬酸钾和浓盐酸制氯气_______ 。
(4) 和
和 固体混合物在高温下发生反应,放出的气体均为黄绿色(
固体混合物在高温下发生反应,放出的气体均为黄绿色( 为黄绿色)
为黄绿色)_______ 。
(5) 将雌黄铁矿(
将雌黄铁矿(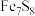 )中的S氧化成
)中的S氧化成
_______ 。
(1)硫酸铝和硅酸钠溶液反应的离子方程式
(2)酚醛树脂的合成
(3)用重铬酸钾和浓盐酸制氯气
(4)
 和
和 固体混合物在高温下发生反应,放出的气体均为黄绿色(
固体混合物在高温下发生反应,放出的气体均为黄绿色( 为黄绿色)
为黄绿色)(5)
 将雌黄铁矿(
将雌黄铁矿(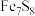 )中的S氧化成
)中的S氧化成
您最近一年使用:0次
8 . 氧化铈(CeO2)是一种应用非常广 泛的稀土氧化物。现以氟碳铺矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
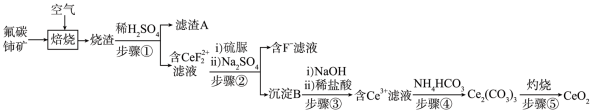
已知:
①稀土离子易与 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
②硫脲: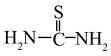 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)2为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是_______ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式_______ 。
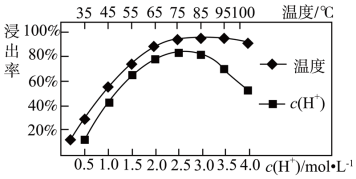
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,图示中H+浓度大于2.5mol·L-1时,浸出率降低的原因是_______ 。
(4)加入硫脲的目的是将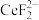 还原为Ce3+,反应的 离子方程式为
还原为Ce3+,反应的 离子方程式为_______ 。
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为_______ 。
(6)下列关于步骤④的说法错误的是_______ (填字 母)。
(7)取所得产品CeO2 8.00g溶解后配成250mL溶液。取25.00 mL该溶液用0.20 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应Fe2++Ce4+=Fe3+ +Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为_______ 。(保留两位小数)。

已知:
①稀土离子易与
 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;②硫脲:
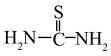 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)2为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,图示中H+浓度大于2.5mol·L-1时,浸出率降低的原因是

(4)加入硫脲的目的是将
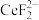 还原为Ce3+,反应的 离子方程式为
还原为Ce3+,反应的 离子方程式为(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(6)下列关于步骤④的说法错误的是_______ (填字 母)。
A.该步骤发生的反应是2Ce3+ +6 =Ce2(CO3)3↓ +3CO2↑+3H2O =Ce2(CO3)3↓ +3CO2↑+3H2O |
| B.可以用(NH4)2CO3溶液代替NH4 HCO3溶液,不影响产品纯度 |
| C.过滤时选择减压过滤能够大大提高过滤效率 |
| D.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率 |
您最近一年使用:0次
名校
9 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了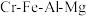 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为___________ 。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)工序③中发生反应的离子方程式为___________ 。
(4)热解工序产生的混合气体最适宜返回工序___________ (填“①”或“②”或“③”或“④”)参与内循环。
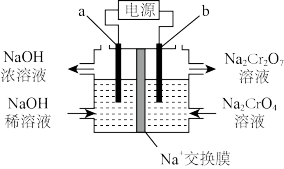
(5)工序③也可以利用电解法制 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的___________ 极相连,制备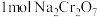 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的 为
为___________ 。(通常认为溶液中离子浓度等于 为恰好沉淀完全;已知
为恰好沉淀完全;已知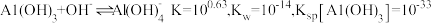 )
)
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)热解工序产生的混合气体最适宜返回工序
(5)工序③也可以利用电解法制
 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的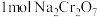 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重
(6)工序④溶液中的铝元素恰好完全转化为沉淀的
 为
为 为恰好沉淀完全;已知
为恰好沉淀完全;已知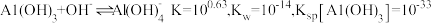 )
)
您最近一年使用:0次
名校
解题方法
10 . 以废旧锂离子电池的正极材料[活性物质为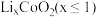 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和 。
。
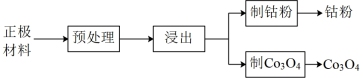
(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是_______ 。
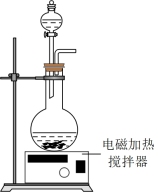
(2)浸出,将煅烧后的粉末(含 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到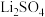 、
、 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到_______ ,可以判断反应结束,不再滴加双氧水。
(3)制钴粉。向浸出后的溶液中加入NaOH调节pH,接着加入 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物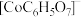 。
。
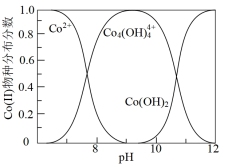
①写出pH=9时制钴粉的离子方程式:_______ 。
②pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠( ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是_______ 。
(4)请补充完整由浸取后滤液先制备 ,并进一步制取
,并进一步制取 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液,_______ ,得到 。[已知:
。[已知: 易溶于水,
易溶于水, 难溶于水,
难溶于水, 在空气中加热时的固体残留率(
在空气中加热时的固体残留率(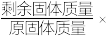 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
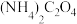 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]

(5)用下列实验可以测定 的组成:
的组成:
实验1:准确你取一定质量的 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。
实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000 EDTA(
EDTA( )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。
实验3:准确称取与实验1中等质量的 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中 浓度为
浓度为
 。
。
计算 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程_______ 。
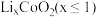 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和 。
。
(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是
(2)浸出,将煅烧后的粉末(含
 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到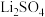 、
、 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到
(3)制钴粉。向浸出后的溶液中加入NaOH调节pH,接着加入
 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物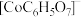 。
。
①写出pH=9时制钴粉的离子方程式:
②pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠(
 ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是(4)请补充完整由浸取后滤液先制备
 ,并进一步制取
,并进一步制取 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液, 。[已知:
。[已知: 易溶于水,
易溶于水, 难溶于水,
难溶于水, 在空气中加热时的固体残留率(
在空气中加热时的固体残留率(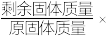 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
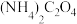 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]
(5)用下列实验可以测定
 的组成:
的组成:实验1:准确你取一定质量的
 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000
 EDTA(
EDTA( )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。实验3:准确称取与实验1中等质量的
 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中 浓度为
浓度为
 。
。计算
 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程
您最近一年使用:0次
2022-05-26更新
|
1262次组卷
|
3卷引用:江苏省如皋中学2022届高三5月适应性考试(三)化学试题



