解题方法
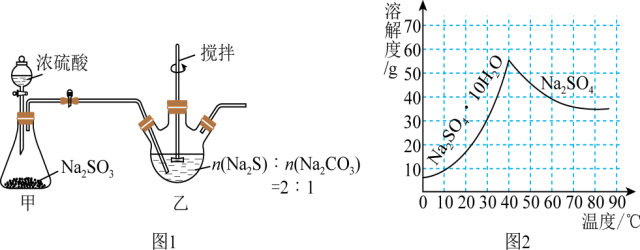
1 . Na2S2O3又名“大苏打”“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,在中性和碱性环境中稳定。某化学实验小组用如图1装置(略去对乙的加热装置)制备Na2S2O3·5H2O(M=248g·mol-1),已知:Na2SO4溶解度如图2所示。_______ 。
(2)在装置乙中溶解两种固体时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的_______ ;装置乙中生成Na2S2O3的总反应方程式为_______ 。
(3)实验过程中,当装置乙中pH接近7.0时,应立即停止通SO2的原因是________ (用离子方程式表示)。
(4)装置乙中需向反应后的混合液加入一定量的无水乙醇,其目的是_______ 。
(5)设计实验测定Na2S2O3·5H2O的纯度:
步骤1:准确称取16.00g样品,溶于水,加入10mL甲醛,配成200mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入 蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL1%淀粉溶液,用待测Na2S2O3溶液滴定碘量瓶中溶液至终点,消耗Na2S2O3溶液 。(已知:I2+2S2O
。(已知:I2+2S2O =2I-+S4O
=2I-+S4O ),试计算Na2S2O3·5H2O的纯度为
),试计算Na2S2O3·5H2O的纯度为_______ (保留三位有效数字)。
(6)利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备Na2SO4·10H2O晶体,将下列实验方案补充完整:将固体混合物溶于水配成溶液,_______ ,洗涤、干燥得Na2SO4·10H2O晶体。(实验中须使用氧气、pH计)
(2)在装置乙中溶解两种固体时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的
(3)实验过程中,当装置乙中pH接近7.0时,应立即停止通SO2的原因是
(4)装置乙中需向反应后的混合液加入一定量的无水乙醇,其目的是
(5)设计实验测定Na2S2O3·5H2O的纯度:
步骤1:准确称取16.00g样品,溶于水,加入10mL甲醛,配成200mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入
 蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
蒸馏水溶解,再加入5mL2mol·L-1硫酸溶液和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。步骤3:向碘量瓶中加入1mL1%淀粉溶液,用待测Na2S2O3溶液滴定碘量瓶中溶液至终点,消耗Na2S2O3溶液
 。(已知:I2+2S2O
。(已知:I2+2S2O =2I-+S4O
=2I-+S4O ),试计算Na2S2O3·5H2O的纯度为
),试计算Na2S2O3·5H2O的纯度为(6)利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备Na2SO4·10H2O晶体,将下列实验方案补充完整:将固体混合物溶于水配成溶液,
您最近一年使用:0次
2022-12-15更新
|
681次组卷
|
5卷引用:山东省菏泽市2022届高三二模考试化学试题
山东省菏泽市2022届高三二模考试化学试题(已下线)化学(福建A卷)-学易金卷:2023年高考第一次模拟考试(已下线)二轮专题强化练 大题突破2 综合实验题题型研究浙江省Lambda联盟2023-2024学年高三下学期第一次联考化学试题浙江省2024届高三下学期5月选考适应性考试化学试题
名校
解题方法
2 . NaClO2·3H2O具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
I.下列是制备NaClO2·3H2O的一种流程:
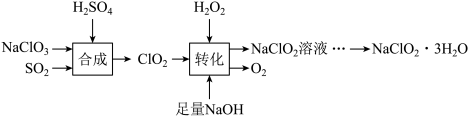
已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
(1)写出“合成”中发生反应的离子方程式:___________________________________________ 。
(2)“转化”过程中反应的化学方程式是______________________________________________ 。
(3)由NaClO2溶液得到NaClO2·3H2O的操作为:蒸发浓缩,___________ ,过滤洗涤,得到NaClO2·3H2O产品。
II.为确定产品的纯度,进行如下实验:
步骤1:取20.00gNaClO2·3H2O样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的1.000mol/LKI溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至终点。
步骤3:重复以上操作2~3次,测得滴定Na2S2O3溶液的平均体积为22.00mL。
已知: +4I-+4H+=Cl-+2I2+2H2O,I2+2
+4I-+4H+=Cl-+2I2+2H2O,I2+2 =2I-+
=2I-+
(4)试计算该NaClO2·3H2O样品的纯度___________ 。
I.下列是制备NaClO2·3H2O的一种流程:

已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
(1)写出“合成”中发生反应的离子方程式:
(2)“转化”过程中反应的化学方程式是
(3)由NaClO2溶液得到NaClO2·3H2O的操作为:蒸发浓缩,
II.为确定产品的纯度,进行如下实验:
步骤1:取20.00gNaClO2·3H2O样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的1.000mol/LKI溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至终点。
步骤3:重复以上操作2~3次,测得滴定Na2S2O3溶液的平均体积为22.00mL。
已知:
 +4I-+4H+=Cl-+2I2+2H2O,I2+2
+4I-+4H+=Cl-+2I2+2H2O,I2+2 =2I-+
=2I-+
(4)试计算该NaClO2·3H2O样品的纯度
您最近一年使用:0次
2022-12-09更新
|
822次组卷
|
3卷引用:江苏省徐州市沛县歌风中学2021-2022学年高一12月学情检测化学试题
2022·浙江·模拟预测
解题方法
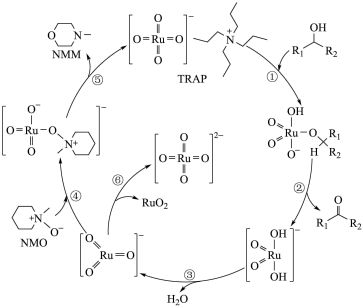
3 .  是一种温和的氧化剂,
是一种温和的氧化剂, 试剂中的RuO
试剂中的RuO 不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。
不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。 氧化醇的反应机理如下图,下列说法不正确的是
氧化醇的反应机理如下图,下列说法不正确的是
 是一种温和的氧化剂,
是一种温和的氧化剂, 试剂中的RuO
试剂中的RuO 不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。
不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。 氧化醇的反应机理如下图,下列说法不正确的是
氧化醇的反应机理如下图,下列说法不正确的是
| A.在上述6步反应中发生氧化还原反应的不只2步 |
B.步骤④⑤中NMO将RuO 还原,生成 还原,生成 试剂 试剂 |
C.步骤⑥的离子方程式为2RuO = RuO2+ RuO = RuO2+ RuO |
D.若R1为CH3CH=CH-,R2为-H,则 氧化该醇的主产物为2-丁烯醛 氧化该醇的主产物为2-丁烯醛 |
您最近一年使用:0次
名校
解题方法
4 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1511次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
5 . 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测所得固体中含有 和白色物质X,下列说法正确的是
和白色物质X,下列说法正确的是
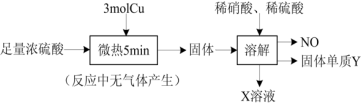
 和白色物质X,下列说法正确的是
和白色物质X,下列说法正确的是
A.白色物质X为 ,体现了浓硫酸具有吸水性 ,体现了浓硫酸具有吸水性 |
| B.NO和Y均为还原产物 |
| C.3mol Cu参与反应,转移了6mol电子 |
| D.若稀硫酸足量,在溶解的环节中至少需要0.8mol的稀硝酸 |
您最近一年使用:0次
2022-12-03更新
|
1010次组卷
|
3卷引用: 山东省济宁市兖州区2022-2023学年高三上学期期中考试化学试题
名校
解题方法
6 . 白磷(P4)有毒,实验时若皮肤接触到白磷,应立即用稀CuSO4溶液清洗,发生两个反应:
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
| A.在反应①和②中,P4只作还原剂 |
| B.反应①中氧化产物与还原产物的个数之比为5∶2 |
| C.皮肤接触到白磷,用稀CuSO4溶液清洗后,应再使用NaOH溶液清洗 |
| D.若P4反应完全且转化为H3PO4的转化率是80%,理论上反应①和②消耗P4的个数之比为14∶11 |
您最近一年使用:0次
2022-11-09更新
|
1331次组卷
|
4卷引用:重庆实验外国语学校2022-2023学年高一上学期期中检测化学试题
2022高二上·安徽阜阳·竞赛
解题方法
7 . 化学一直都在发展……
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO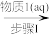 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O Cu(NO3)2(无水)
Cu(NO3)2(无水)
已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为_______ (填写化学式),步骤III中加入SOCl2的作用是_______ ,写出步骤III发生的化学反应的化学方程式_______ 。
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了_______ (填反应类型),其反应的化学方程式为_______ 。
②现如今化学家们发明了另一种制备方法:
Cu(s) Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4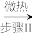 Cu(NO3)2
Cu(NO3)2
已知:在液态N2O4中存在一下自耦电离平衡:N2O4 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
(3)试写出步骤I与步骤II的方程式:步骤I_______ ;步骤II_______ 。
(4)该反应的优点(写出一条即可):_______ 。
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO
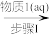 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O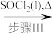 Cu(NO3)2(无水)
Cu(NO3)2(无水)已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了
②现如今化学家们发明了另一种制备方法:
Cu(s)
 Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4 Cu(NO3)2
Cu(NO3)2已知:在液态N2O4中存在一下自耦电离平衡:N2O4
 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分(3)试写出步骤I与步骤II的方程式:步骤I
(4)该反应的优点(写出一条即可):
您最近一年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
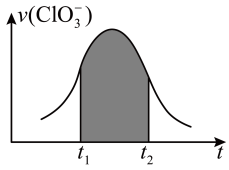
8 . 已知氯酸钾和和亚硫酸氢钾可以发生氧化还原反应(无污染性气体产生),且反应中被氧化被还原的元素个数都只有一个。若该反应的反应速率会随着c(H+)的提升而加快,下图为ClO 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
| A.反应进行一段时间后速率下降可能是因为c(OH-)的浓度下降导致。 |
| B.纵坐标为v(H+)的v-t曲线在通过平移后可与图中图象完全重合。 |
C.图中阴影部分的面积表示t1~t2时间内ClO 的物质的量的减少量。 的物质的量的减少量。 |
| D.系数为最简整数比时,每摩尔反应转移6mol e-并产生3mol质子。 |
您最近一年使用:0次
名校
解题方法
9 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中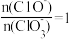 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2106次组卷
|
12卷引用:江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题
江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
10 . 铬酸铅俗称铬黄,是一种难溶于水的黄色固体,也是一种重要的黄色颜料,常用作橡胶、油墨、水彩、色纸等的着色剂。工业上用草酸泥渣(主要含草酸铅、硫酸铅)和铬矿渣(主要成分为 ,含有少量的
,含有少量的 )为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
)为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
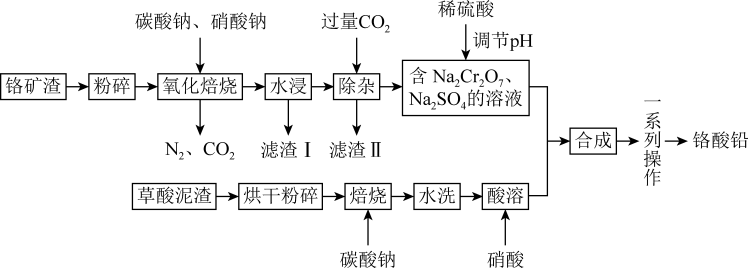
回答下列问题:
(1)将铬矿渣“粉碎"”的目的是_______ ;草酸泥渣“焙烧”后“水洗”的作用是_______ 。
(2)“滤渣Ⅱ”的主要成分是_______ (填化学式)。
(3)“氧化焙烧”时, 被氧化的反应的化学方程式为
被氧化的反应的化学方程式为_______ 。
(4)“一系列操作”包括_______ 、粉碎。
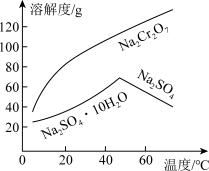
(5)为了使产品更纯,需将“含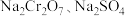 的溶液”分离提纯,依据如图所示的溶解度信息,“含
的溶液”分离提纯,依据如图所示的溶解度信息,“含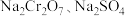 的溶液”分离提纯的操作是
的溶液”分离提纯的操作是_______ 。分离提纯后得到的固体的化学式为_______ 。
(6)“焙烧”时加入碳酸钠是为了将硫酸铅转化为氧化铅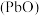 ,同时放出二氧化碳,该转化过程的化学方程式为
,同时放出二氧化碳,该转化过程的化学方程式为_______ 。
 ,含有少量的
,含有少量的 )为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
)为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
回答下列问题:
(1)将铬矿渣“粉碎"”的目的是
(2)“滤渣Ⅱ”的主要成分是
(3)“氧化焙烧”时,
 被氧化的反应的化学方程式为
被氧化的反应的化学方程式为(4)“一系列操作”包括
(5)为了使产品更纯,需将“含
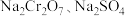 的溶液”分离提纯,依据如图所示的溶解度信息,“含
的溶液”分离提纯,依据如图所示的溶解度信息,“含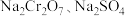 的溶液”分离提纯的操作是
的溶液”分离提纯的操作是
(6)“焙烧”时加入碳酸钠是为了将硫酸铅转化为氧化铅
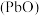 ,同时放出二氧化碳,该转化过程的化学方程式为
,同时放出二氧化碳,该转化过程的化学方程式为
您最近一年使用:0次



