1 . 书写方程式
(1)硫酸铝和硅酸钠溶液反应的离子方程式_______ 。
(2)酚醛树脂的合成_______ 。
(3)用重铬酸钾和浓盐酸制氯气_______ 。
(4) 和
和 固体混合物在高温下发生反应,放出的气体均为黄绿色(
固体混合物在高温下发生反应,放出的气体均为黄绿色( 为黄绿色)
为黄绿色)_______ 。
(5) 将雌黄铁矿(
将雌黄铁矿(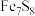 )中的S氧化成
)中的S氧化成
_______ 。
(1)硫酸铝和硅酸钠溶液反应的离子方程式
(2)酚醛树脂的合成
(3)用重铬酸钾和浓盐酸制氯气
(4)
 和
和 固体混合物在高温下发生反应,放出的气体均为黄绿色(
固体混合物在高温下发生反应,放出的气体均为黄绿色( 为黄绿色)
为黄绿色)(5)
 将雌黄铁矿(
将雌黄铁矿(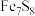 )中的S氧化成
)中的S氧化成
您最近一年使用:0次
2 . 氧化铈(CeO2)是一种应用非常广 泛的稀土氧化物。现以氟碳铺矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
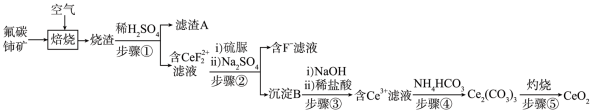
已知:
①稀土离子易与 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
②硫脲: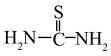 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)2为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是_______ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式_______ 。
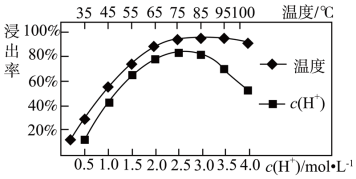
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,图示中H+浓度大于2.5mol·L-1时,浸出率降低的原因是_______ 。
(4)加入硫脲的目的是将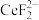 还原为Ce3+,反应的 离子方程式为
还原为Ce3+,反应的 离子方程式为_______ 。
(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为_______ 。
(6)下列关于步骤④的说法错误的是_______ (填字 母)。
(7)取所得产品CeO2 8.00g溶解后配成250mL溶液。取25.00 mL该溶液用0.20 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,滴定时发生反应Fe2++Ce4+=Fe3+ +Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为_______ 。(保留两位小数)。

已知:
①稀土离子易与
 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应:Ce2(SO4)3+ Na2SO4 +nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;②硫脲:
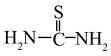 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)2为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,图示中H+浓度大于2.5mol·L-1时,浸出率降低的原因是

(4)加入硫脲的目的是将
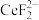 还原为Ce3+,反应的 离子方程式为
还原为Ce3+,反应的 离子方程式为(5)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(6)下列关于步骤④的说法错误的是_______ (填字 母)。
A.该步骤发生的反应是2Ce3+ +6 =Ce2(CO3)3↓ +3CO2↑+3H2O =Ce2(CO3)3↓ +3CO2↑+3H2O |
| B.可以用(NH4)2CO3溶液代替NH4 HCO3溶液,不影响产品纯度 |
| C.过滤时选择减压过滤能够大大提高过滤效率 |
| D.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率 |
您最近一年使用:0次
名校
3 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了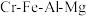 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为___________ 。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)工序③中发生反应的离子方程式为___________ 。
(4)热解工序产生的混合气体最适宜返回工序___________ (填“①”或“②”或“③”或“④”)参与内循环。
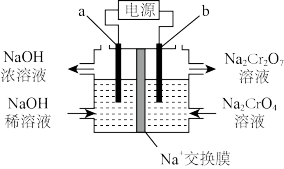
(5)工序③也可以利用电解法制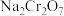 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的___________ 极相连,制备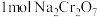 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的 为
为___________ 。(通常认为溶液中离子浓度等于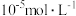 为恰好沉淀完全;已知
为恰好沉淀完全;已知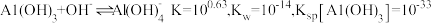 )
)
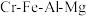 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)热解工序产生的混合气体最适宜返回工序
(5)工序③也可以利用电解法制
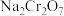 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的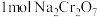 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重
(6)工序④溶液中的铝元素恰好完全转化为沉淀的
 为
为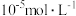 为恰好沉淀完全;已知
为恰好沉淀完全;已知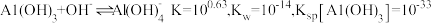 )
)
您最近一年使用:0次
名校
解题方法
4 . 以废旧锂离子电池的正极材料[活性物质为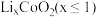 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和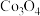 。
。
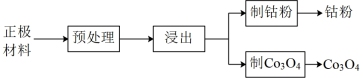
(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是_______ 。
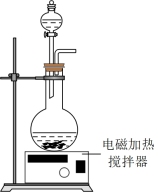
(2)浸出,将煅烧后的粉末(含 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到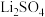 、
、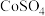 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到_______ ,可以判断反应结束,不再滴加双氧水。
(3)制钴粉。向浸出后的溶液中加入NaOH调节pH,接着加入 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物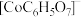 。
。
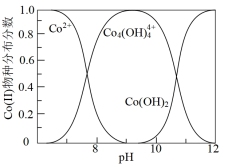
①写出pH=9时制钴粉的离子方程式:_______ 。
②pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠( ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是_______ 。
(4)请补充完整由浸取后滤液先制备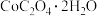 ,并进一步制取
,并进一步制取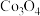 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液,_______ ,得到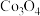 。[已知:
。[已知: 易溶于水,
易溶于水,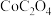 难溶于水,
难溶于水,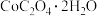 在空气中加热时的固体残留率(
在空气中加热时的固体残留率(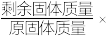 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
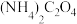 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]

(5)用下列实验可以测定 的组成:
的组成:
实验1:准确你取一定质量的 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在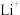 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。
实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000 EDTA(
EDTA(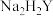 )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。
实验3:准确称取与实验1中等质量的 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中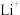 浓度为
浓度为
 。
。
计算 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程_______ 。
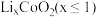 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和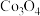 。
。
(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是
(2)浸出,将煅烧后的粉末(含
 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到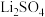 、
、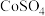 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到
(3)制钴粉。向浸出后的溶液中加入NaOH调节pH,接着加入
 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物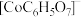 。
。
①写出pH=9时制钴粉的离子方程式:
②pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠(
 ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是(4)请补充完整由浸取后滤液先制备
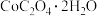 ,并进一步制取
,并进一步制取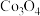 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液,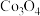 。[已知:
。[已知: 易溶于水,
易溶于水,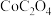 难溶于水,
难溶于水,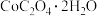 在空气中加热时的固体残留率(
在空气中加热时的固体残留率(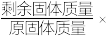 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
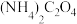 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]
(5)用下列实验可以测定
 的组成:
的组成:实验1:准确你取一定质量的
 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在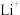 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000
 EDTA(
EDTA(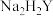 )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。实验3:准确称取与实验1中等质量的
 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中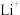 浓度为
浓度为
 。
。计算
 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程
您最近一年使用:0次
2022-05-26更新
|
1272次组卷
|
3卷引用:江苏省如皋中学2022届高三5月适应性考试(三)化学试题
名校
5 . 金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬,冶炼流程如下。

已知:4FeCr2O4+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3
8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
回答下列问题:
(1)实验室氧化煅烧时需用到的仪器有坩埚、___________ 、坩埚钳、三脚架、酒精灯。
(2)下列说法正确的是___________。
(3)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的Na2Cr2O7·2H2O晶体,请给出操作的正确顺序:(操作可重复)d→ → → →c→e→ → →c→e。___________

a.将溶液(或滤液)蒸发至溶液表面出现晶膜
b.在60 ℃蒸发溶剂
c.冷却至室温
d.在100 ℃蒸发溶剂
e.过滤
(4)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,写出该反应的化学方程式:___________ 。
(5)工业上用铝粉还原Cr2O3而不用C粉还原得到单质铬的原因是___________ 。
(6)为了测定Na2Cr2O7产品的纯度,可采用FeSO4标准溶液通过氧化还原反应滴定Na2Cr2O7溶液。下列关于滴定分析的操作,不正确 的是___________ 。
A.用移液管量取25.00 mL待测液转移至锥形瓶
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.排气泡时应使管尖弯曲向上,用右手挤压玻璃珠上方,使液面充满管尖
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.第一次滴定终点时,若测得消耗标准液体积小于5.00 mL,则第二次滴定时可稀释标准溶液后重新滴定来减小误差

已知:4FeCr2O4+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3
8Na2CrO4+2Fe2O3+8CO2、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑回答下列问题:
(1)实验室氧化煅烧时需用到的仪器有坩埚、
(2)下列说法正确的是___________。
| A.步骤①可通过加热方式加快浸出速率 |
| B.步骤②③均可采用减压过滤的方法加快过滤速度 |
| C.步骤③为调节溶液pH可以加入适量的碱性溶液 |
| D.步骤④中可用盐酸代替硫酸调节溶液酸碱性 |

a.将溶液(或滤液)蒸发至溶液表面出现晶膜
b.在60 ℃蒸发溶剂
c.冷却至室温
d.在100 ℃蒸发溶剂
e.过滤
(4)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,写出该反应的化学方程式:
(5)工业上用铝粉还原Cr2O3而不用C粉还原得到单质铬的原因是
(6)为了测定Na2Cr2O7产品的纯度,可采用FeSO4标准溶液通过氧化还原反应滴定Na2Cr2O7溶液。下列关于滴定分析的操作,
A.用移液管量取25.00 mL待测液转移至锥形瓶
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.排气泡时应使管尖弯曲向上,用右手挤压玻璃珠上方,使液面充满管尖
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.第一次滴定终点时,若测得消耗标准液体积小于5.00 mL,则第二次滴定时可稀释标准溶液后重新滴定来减小误差
您最近一年使用:0次
解题方法
6 . H2O2、O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),能有效去除废水中的H2PO 、CN-、苯酚等物质
、CN-、苯酚等物质
(1)H2O2、O3在一定条件可处理废水中H2PO 。
。
①弱碱性条件下·OH将H2PO 氧化成PO
氧化成PO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②为比较不同投料方式下含H2PO 模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示。
模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示。
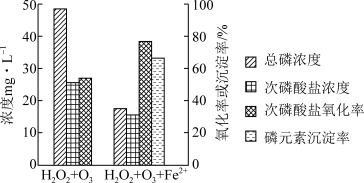
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是___________ 。
(2)H2O2、O2在一定条件下可处理废水中的CN-。
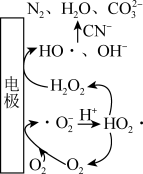
①工业上通过电激发O2处理废水中的CN-,反应机理如图所示,其过程可描述为___________ 。
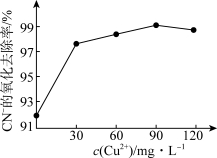
②已知Cu2+可催化过氧化氢氧化CN-。在含氰废水总量、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化如图所示。c(Cu2+)超过90 mg·L-1时,CN-的氧化去除率有所下降,原因是___________ 。
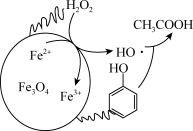
(3)H2O2在Fe3O4催化下可有效除去废水中的苯酚等有机污染物。除去废水中的苯酚的原理如图所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是___________ 。
 、CN-、苯酚等物质
、CN-、苯酚等物质(1)H2O2、O3在一定条件可处理废水中H2PO
 。
。①弱碱性条件下·OH将H2PO
 氧化成PO
氧化成PO ,该反应的离子方程式为
,该反应的离子方程式为②为比较不同投料方式下含H2PO
 模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示。
模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示。
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是
(2)H2O2、O2在一定条件下可处理废水中的CN-。
①工业上通过电激发O2处理废水中的CN-,反应机理如图所示,其过程可描述为

②已知Cu2+可催化过氧化氢氧化CN-。在含氰废水总量、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化如图所示。c(Cu2+)超过90 mg·L-1时,CN-的氧化去除率有所下降,原因是

(3)H2O2在Fe3O4催化下可有效除去废水中的苯酚等有机污染物。除去废水中的苯酚的原理如图所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是

您最近一年使用:0次
名校
7 . 将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 的体积和剩余金属的质量如下表(设硝酸的还原产物只有
的体积和剩余金属的质量如下表(设硝酸的还原产物只有 )。下列说法正确的是
)。下列说法正确的是
 的体积和剩余金属的质量如下表(设硝酸的还原产物只有
的体积和剩余金属的质量如下表(设硝酸的还原产物只有 )。下列说法正确的是
)。下列说法正确的是| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.6 | 9.6 | 0 | 0 |
| NO体积/L | 2.24 | 4.48 | 6.72 | V |
A.①中溶液存在 | B.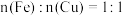 |
C.硝酸的浓度为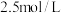 | D.④中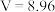 |
您最近一年使用:0次
2022-05-03更新
|
1546次组卷
|
3卷引用:湖北省六校新高考联盟2021-2022学年高一下学期4月联考化学试题
名校
解题方法
8 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
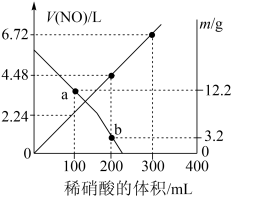

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3635次组卷
|
14卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
2022高三·全国·专题练习
9 . 化学上常用标准电极电势φ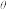 (氧化型/还原型)比较物质氧化能力。φ
(氧化型/还原型)比较物质氧化能力。φ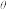 值越高,氧化型物质的氧化能力越强,φ
值越高,氧化型物质的氧化能力越强,φ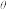 值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
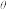 (氧化型/还原型)比较物质氧化能力。φ
(氧化型/还原型)比较物质氧化能力。φ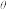 值越高,氧化型物质的氧化能力越强,φ
值越高,氧化型物质的氧化能力越强,φ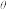 值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是| 氧化型/还原型 | φ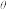 (Co3+/Co2+) (Co3+/Co2+) | φ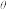 (HClO/Cl-) (HClO/Cl-) |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φ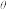 [Co(OH)3/Co(OH)2] [Co(OH)3/Co(OH)2] | φ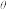 (ClO-/Cl-) (ClO-/Cl-) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知,氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
10 . 人类社会的发展离不开“求知求真”.某化学兴趣小组以 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
(1)实验预测
(2)实验探究
实验一:探究 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有_______ [已知: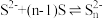 ]。
]。

实验二:探究 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:
实验结论
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。(1)实验预测
| 推测可能发生的反应 | 推测依据 | 预期的实验现象 |
| ①氧化还原反应 |  具有一定的氧化性, 具有一定的氧化性, 具有较强的还原性 具有较强的还原性 | 若 过量,则有淡黄色沉淀(S)生成若 过量,则有淡黄色沉淀(S)生成若 过量,则有黑色沉淀 过量,则有黑色沉淀 |
| ②复分解反应 |  为黑色难溶物, 为黑色难溶物,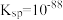 | 有黑色固体生成 |
| ③彻底双水解反应 |  、 、 水解能力均较强 水解能力均较强 | 有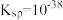 )产生,同时有臭鸡蛋气味的气体(H2S)生成 )产生,同时有臭鸡蛋气味的气体(H2S)生成 |
实验一:探究
 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有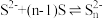 ]。
]。
实验二:探究
 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:| 实验步骤 | 实验现象 | 实验解释或结论 |
ⅰ.向 饱和 饱和 溶液中,滴加2滴饱和 溶液中,滴加2滴饱和 溶液 溶液 | 有黑色沉淀生成,而后黑色沉淀消失,出现淡黄色沉淀 | 用离子方程式解释黑色沉淀消失的原因: |
ⅱ.将 饱和 饱和 溶液与 溶液与 饱和 饱和 溶液直接混合 溶液直接混合 | 先有黑色和另一种颜色的沉淀生成,而后都变为黑色;同时有臭鸡蛋气味的气体生成 | 试解释:沉淀最终都变为黑色的原因是 |
ⅲ.取ⅱ中最终生成的黑色沉淀样品,用无水乙醇多次洗涤后,干燥称量得 黑色固体,然后在空气中灼烧至恒重 黑色固体,然后在空气中灼烧至恒重 | 灼烧后,所得红棕色固体质量为 | 经计算判断,黑色固体样品的成份为 |
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
您最近一年使用:0次



