解题方法
1 . 碲(Te)广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为Cu2Te,还含有金、银、铂等)回收碲的工艺流程如下:
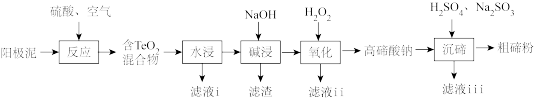
已知:TeO2有强还原性,且TeO2、Cu2TeO4难溶于水;高碲酸钠的化学式:Na2TeO4
回答下列问题:
(1)为提高“反应”效率,可采取的措施为_______ (任答一条)。
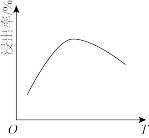
(2)滤液i的主要成分是_______ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释铜的浸出率随温度变化的可能原因_______ 。
(3)“氧化”过程中发生反应的离子方程式为_______ 。滤液ii可循环使用,应将其导入到_______ (写操作单元名称)操作中。
(4)“沉碲”过程中发生反应的离子方程式为_______ 。
(5)粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为_______ 。

已知:TeO2有强还原性,且TeO2、Cu2TeO4难溶于水;高碲酸钠的化学式:Na2TeO4
回答下列问题:
(1)为提高“反应”效率,可采取的措施为
(2)滤液i的主要成分是

(3)“氧化”过程中发生反应的离子方程式为
(4)“沉碲”过程中发生反应的离子方程式为
(5)粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为
您最近一年使用:0次
名校
2 . 液态化合物 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
实验1: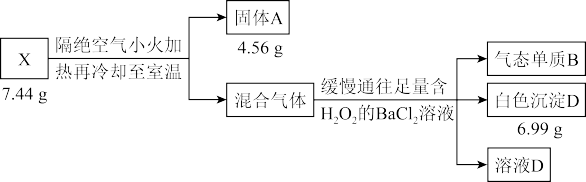
实验2: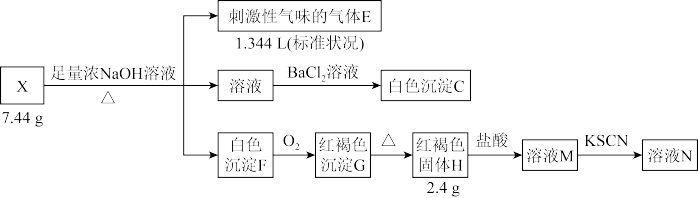
已知:物质 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答:
(1)组成 的元素有
的元素有_______ , 的化学式为
的化学式为_______ 。
(2) 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为_______ 。
(3)溶液 中的溶质有:
中的溶质有: 、
、 、
、_______ (填化学式)。
(4)溶液 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
①向溶液 中加
中加 固体,观察现象;
固体,观察现象;
②向溶液 中加浓
中加浓 溶液,观察现象;
溶液,观察现象;
请设计方案③:_______ (写出操作、现象及相应结论)。
 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:实验1:

实验2:

已知:物质
 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答:(1)组成
 的元素有
的元素有 的化学式为
的化学式为(2)
 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为(3)溶液
 中的溶质有:
中的溶质有: 、
、 、
、(4)溶液
 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:①向溶液
 中加
中加 固体,观察现象;
固体,观察现象;②向溶液
 中加浓
中加浓 溶液,观察现象;
溶液,观察现象;请设计方案③:
您最近一年使用:0次
2022-03-21更新
|
1332次组卷
|
7卷引用:浙江省金丽衢十二校,七彩联盟2021-2022学年高三下学期3月阶段性联考化学试题
浙江省金丽衢十二校,七彩联盟2021-2022学年高三下学期3月阶段性联考化学试题 (已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)化学-2022年高考押题预测卷03(浙江卷)(已下线)化学-2022年高考考前押题密卷(浙江卷)浙江省2022届高三考前第三次模拟考试化学试题新疆乌鲁木齐市第六十八中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
3 . 向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是
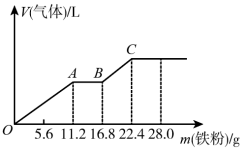

| A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 |
| B.A点溶液中的溶质为FeSO4和H2SO4 |
C.原混合酸中NO 和SO 和SO 物质的量之比为2:1 物质的量之比为2:1 |
| D.原混合酸中H2SO4的物质的量浓度为2mol·L-1 |
您最近一年使用:0次
2022-03-20更新
|
1742次组卷
|
3卷引用:江西省抚州市临川第二中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
4 . 位于3个不同短周期的6种主族元素W、R、Q、X、Y、Z,原子序数依次增大,R为地壳中含量最丰富的元素,W与Q、R与Y分别同主族,X为同周期的简单离子中半径最小的元素。回答下列问题:
(1)请写出元素符号:W为_______ 、R为_______ 、Q为_______ 。
(2)Q、X的最高价氧化物对应水化物之间能发生反应,其离子方程式为_______ 。
(3)实验室制备Z单质的化学方程式:_______ 。
(4)常见化合物甲、乙均含W、R、Q、Y四种元素,则甲、乙两溶液反应的离子方程式为:_______ 。
(5) 和
和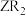 均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g
均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g 的氧化能力相当的
的氧化能力相当的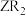 的质量为
的质量为_______ g。
(6)溶液丙 与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为
与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为_______ 。
①1∶1 ②2∶3 ③3∶10 ④3∶11
(1)请写出元素符号:W为
(2)Q、X的最高价氧化物对应水化物之间能发生反应,其离子方程式为
(3)实验室制备Z单质的化学方程式:
(4)常见化合物甲、乙均含W、R、Q、Y四种元素,则甲、乙两溶液反应的离子方程式为:
(5)
 和
和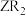 均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g
均可作自来水消毒剂,且消毒时还原产物均为Z-,则与8.7g 的氧化能力相当的
的氧化能力相当的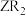 的质量为
的质量为(6)溶液丙
 与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为
与溶液丁(QRW),两种溶液等体积混合后,沉淀物中含X元素的质量是溶液中含X元素的质量的一半,则丙、丁两种溶液物质的量浓度之比可能为①1∶1 ②2∶3 ③3∶10 ④3∶11
您最近一年使用:0次
2022-03-17更新
|
761次组卷
|
2卷引用:福建省龙岩第一中学2021-2022学年高一下学期第二次月考化学试题
5 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
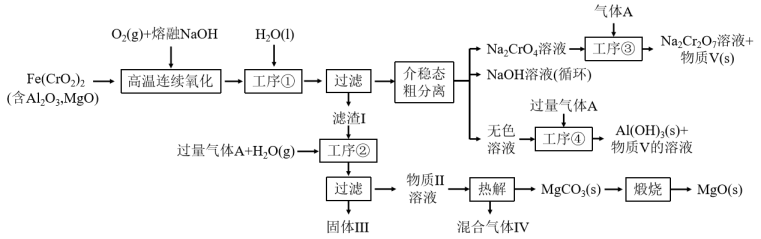
回答下列问题:
(1)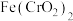 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为_______ 。
(2)工序③操作名称为_______ 。
(3)滤渣I的主要成分是_______ (填化学式)。气体A的化学式为_______ 。
(4)工序④中发生反应的离子方程式为_______ 。
(5)热解工序产生的混合气体最适宜返回工序_______ (填“①”或“②”或“③”或“④”)参与内循环。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;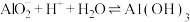 :
: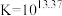 )
)
 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
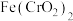 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为(2)工序③操作名称为
(3)滤渣I的主要成分是
(4)工序④中发生反应的离子方程式为
(5)热解工序产生的混合气体最适宜返回工序
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 为沉淀完全;
为沉淀完全;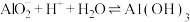 :
: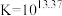 )
)
您最近一年使用:0次
21-22高三上·广东广州·期末
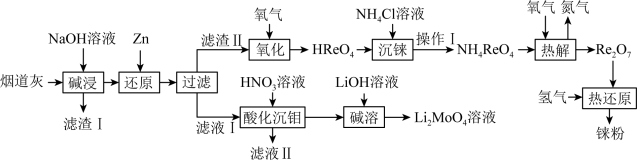
6 . 铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应_______ (填写化学方程式)、MoO3+2NaOH=NaMoO4+H2O,则“滤渣I”的主要成分为_______ (填化学式)。
(2)“还原”时,Zn被氧化成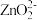 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___________ 。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___________ 、___________ 、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为___________ 。
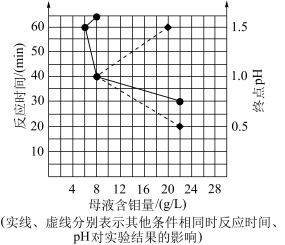
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为___________ min、pH为___________ 。
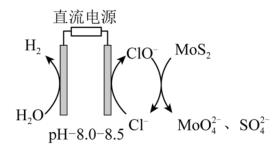
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为______ g。

已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应
(2)“还原”时,Zn被氧化成
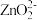 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括
(4)“热解”时,发生反应的化学方程式为
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为

(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为

您最近一年使用:0次
2022-03-08更新
|
862次组卷
|
6卷引用:广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题
(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题湖南省衡阳市第八中学2021-2022学年高三下学期开学考试(第六次月考)化学试题广东名校2021-2022学年高三下学期开学测试化学试题湖南省永州市第四中学2022届高三下学期期中考试化学试题湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第二次月考化学试题
21-22高三上·江苏南通·期末
名校
解题方法
7 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
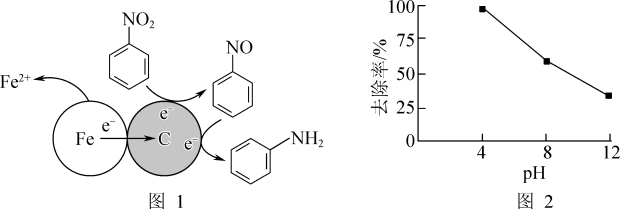
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(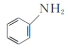 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
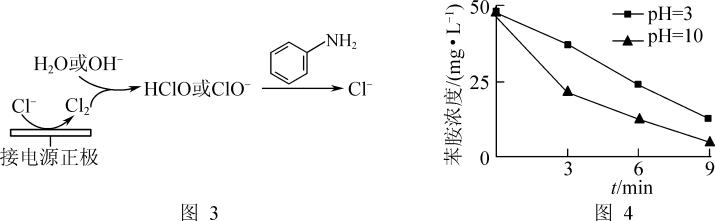
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
8 . 锡酸钠晶体(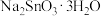 )在电镀、媒染等工业应用广泛,碲(
)在电镀、媒染等工业应用广泛,碲(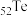 )被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为
)被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为 、
、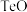 ,还含有少量铁、砷、铅等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下:
,还含有少量铁、砷、铅等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下:
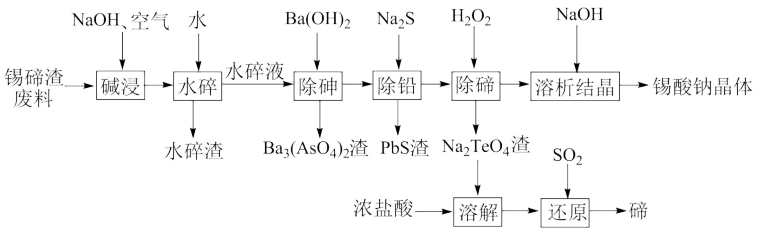
已知:①水碎液中溶质主要成分为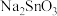 、
、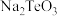 、
、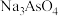 和
和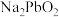 ;
;
②碱性条件下,锡酸钠在水中的溶解度随温度的升高而减小。
回答下列问题:
(1)“碱浸”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“除砷”时,若要使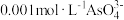 沉淀完全(离子浓度不大于
沉淀完全(离子浓度不大于 ),则需要加入等体积的
),则需要加入等体积的 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为___________ (已知常温下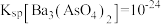 )。
)。
(3)“除铅”时,加入 所发生反应的化学方程式为
所发生反应的化学方程式为___________ 。
(4)“溶析结晶”的操作是___________ ,洗涤,干燥,得到锡酸钠晶体。
(5)“还原”反应中氧化剂与还原剂的物质的量之比为___________ ;
所得碲产品中碲的纯度测定步骤如下:
①取 碲产品,加入酸使其转化为亚碲酸
碲产品,加入酸使其转化为亚碲酸 ,将其配制成
,将其配制成 溶液,取
溶液,取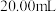 于锥形瓶中。
于锥形瓶中。
②往锥形瓶中加入 酸性
酸性 溶液,充分反应使亚碲酸转化为碲酸
溶液,充分反应使亚碲酸转化为碲酸 。
。
③用 硫酸亚铁铵
硫酸亚铁铵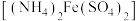 标准溶液滴定剩余的酸性
标准溶液滴定剩余的酸性 溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗
溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗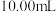 硫酸亚铁铵标准溶液。
硫酸亚铁铵标准溶液。
计算所得碲产品中碲的纯度为___________ 。
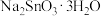 )在电镀、媒染等工业应用广泛,碲(
)在电镀、媒染等工业应用广泛,碲(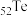 )被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为
)被誉为“国防与尖端技术的维生素”。以锡碲渣废料(主要成分为 、
、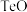 ,还含有少量铁、砷、铅等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下:
,还含有少量铁、砷、铅等元素的氧化物)为原料,制备锡酸钠晶体和碲的工艺流程如下:
已知:①水碎液中溶质主要成分为
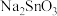 、
、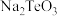 、
、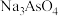 和
和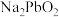 ;
;②碱性条件下,锡酸钠在水中的溶解度随温度的升高而减小。
回答下列问题:
(1)“碱浸”时,
 发生反应的离子方程式为
发生反应的离子方程式为(2)“除砷”时,若要使
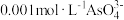 沉淀完全(离子浓度不大于
沉淀完全(离子浓度不大于 ),则需要加入等体积的
),则需要加入等体积的 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为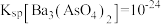 )。
)。(3)“除铅”时,加入
 所发生反应的化学方程式为
所发生反应的化学方程式为(4)“溶析结晶”的操作是
(5)“还原”反应中氧化剂与还原剂的物质的量之比为
所得碲产品中碲的纯度测定步骤如下:
①取
 碲产品,加入酸使其转化为亚碲酸
碲产品,加入酸使其转化为亚碲酸 ,将其配制成
,将其配制成 溶液,取
溶液,取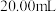 于锥形瓶中。
于锥形瓶中。②往锥形瓶中加入
 酸性
酸性 溶液,充分反应使亚碲酸转化为碲酸
溶液,充分反应使亚碲酸转化为碲酸 。
。③用
 硫酸亚铁铵
硫酸亚铁铵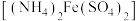 标准溶液滴定剩余的酸性
标准溶液滴定剩余的酸性 溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗
溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗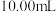 硫酸亚铁铵标准溶液。
硫酸亚铁铵标准溶液。计算所得碲产品中碲的纯度为
您最近一年使用:0次
解题方法
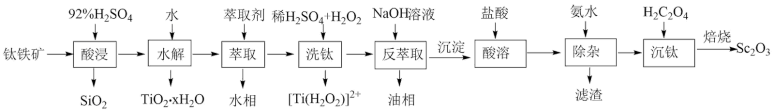
9 . 钪(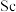 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为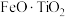 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取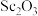 的流程如下:
的流程如下:
已知:①当离子浓度减小至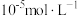 时可认为沉淀完全
时可认为沉淀完全
②室温下,溶液中离子沉淀完全的 如下表所示:
如下表所示:
③ ,
,
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为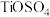 ,其水解反应的化学方程式是
,其水解反应的化学方程式是___________ 。
(2)“萃取”时,使用 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________  。
。
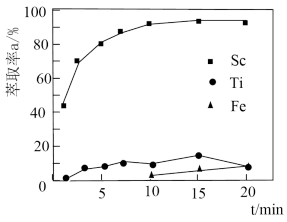
(3)“洗钛”所得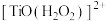 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是___________ 。(写出两点)
(4)“酸溶”后滤液中存在的阳离子 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是___________ 。
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。
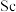 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为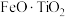 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取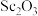 的流程如下:
的流程如下:
已知:①当离子浓度减小至
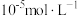 时可认为沉淀完全
时可认为沉淀完全②室温下,溶液中离子沉淀完全的
 如下表所示:
如下表所示:| 离子 |  |  |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
,回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为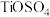 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(2)“萃取”时,使用
 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
(3)“洗钛”所得
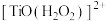 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是(4)“酸溶”后滤液中存在的阳离子
 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 从矿物学资料查得,一定条件下自然界中存在反应 。(其中
。(其中 中Fe为+2价S为-1价)下列说法正确的是
中Fe为+2价S为-1价)下列说法正确的是
 。(其中
。(其中 中Fe为+2价S为-1价)下列说法正确的是
中Fe为+2价S为-1价)下列说法正确的是A. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B.参与反应的 与转移电子数之比为1∶2 与转移电子数之比为1∶2 |
C. 只作还原剂 只作还原剂 |
D.产物中的 有一部分是氧化产物 有一部分是氧化产物 |
您最近一年使用:0次
2022-01-13更新
|
2084次组卷
|
4卷引用:江西省奉新县部分学校2021-2022学年高一上学期第二次月考化学试题



