名校
解题方法
1 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
2021-11-05更新
|
1096次组卷
|
2卷引用:浙江省诸暨市2018-2019学年高二下学期期末考试化学试题
解题方法
2 . 卡尔-费休(Karl-Fischer) 法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N,有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为___________ 。
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是___________ 。
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:___________ 。。
(4)测定20.0 mL有机溶剂含水量____ 。库仑滴定时,以24.8 mA恒定电流通电302s时达到反应终点(电极反应: 2I-- 2e = I2)。求该有机溶剂的含水量(mg·L-1) ____ 。已知: 1 mol电子的电量为9.65× 104C,电量计算公式Q=It
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:
(4)测定20.0 mL有机溶剂含水量
您最近一年使用:0次
解题方法
3 . 写出下列反应的方程式
(1)硫代硫酸钠与稀盐酸混合,生成有刺激性气味的气体_______
(2)氯酸钾、硫酸锰与氢氧化钾共熔,生成绿色物质_______
(3)在重铬酸钾溶液中加入少量银离子,生成砖红色沉淀_______
(4)金溶解在王水中_______
(1)硫代硫酸钠与稀盐酸混合,生成有刺激性气味的气体
(2)氯酸钾、硫酸锰与氢氧化钾共熔,生成绿色物质
(3)在重铬酸钾溶液中加入少量银离子,生成砖红色沉淀
(4)金溶解在王水中
您最近一年使用:0次
解题方法
4 . 化学正在走向精准。当代化学的三大支柱是:理论、实验和计算。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。______
Ⅱ.某硫铜矿的主要成分为 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):
步骤1:在1.00g试样中加入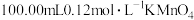 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用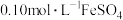 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数______ 。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为
 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。Ⅱ.某硫铜矿的主要成分为
 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):步骤1:在1.00g试样中加入
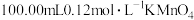 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用
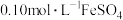 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数
您最近一年使用:0次
解题方法
5 . 化合物 A是近十年开始采用的锅炉水添加剂。A的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(1)A是用碳酸二甲酯和一水合肼在70°C下合成的,收率80%。 画出A的结构式___________ 。
(2)写出合成A的反应方程式___________ 。
(3)低于135°C时,A直接与溶解氧反应,生成三种产物。写出化学方程式___________ 。
(4) 高于135°C时,A先发生水解,水解产物再与氧反应。写出化学方程式___________ 。
(5)化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式___________ 。
(6)化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。 结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象___________ 。
(1)A是用碳酸二甲酯和一水合肼在70°C下合成的,收率80%。 画出A的结构式
(2)写出合成A的反应方程式
(3)低于135°C时,A直接与溶解氧反应,生成三种产物。写出化学方程式
(4) 高于135°C时,A先发生水解,水解产物再与氧反应。写出化学方程式
(5)化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式
(6)化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。 结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象
您最近一年使用:0次
20-21高二下·浙江·阶段练习
6 . 某兴趣小组对化合物X开展实验探究。
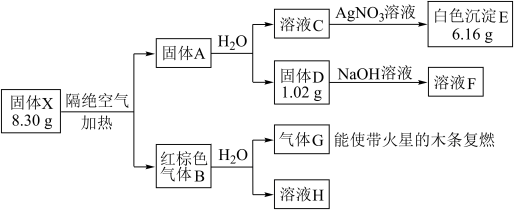
其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是_______________ (填元素符号),E的化学式是______________ 。
(2)固体X隔绝空气加热分解的化学方程式____________________________ 。
(3)写出溶液F与少量溶液H反应的离子方程式____________________________ 。
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为_______ mol/L (设溶质不扩散,)。
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:______________ 。

其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是
(2)固体X隔绝空气加热分解的化学方程式
(3)写出溶液F与少量溶液H反应的离子方程式
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:
您最近一年使用:0次
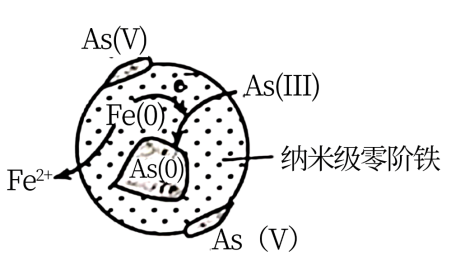
7 . As(0)、As(Ⅲ)和As(V)分别表示砷单质、三价砷和五价砷的化合物。硫酸厂产生的酸性废水中含有超标的H3AsO3,需处理达标后才能排放。目前含砷废水的处理常用石灰中和-PFS、氧化吸附、纳米级零价铁等方法。
(1)石灰中和-PFS法,处理过程如下:
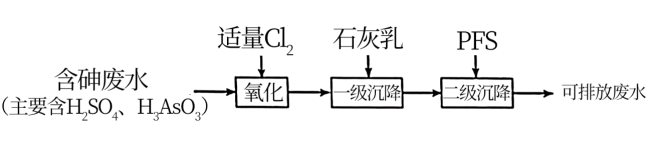
含砷废水经氧化后,加入石灰乳,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如图1所示。H3AsO3水溶液中含砷微粒的物质的量分布分数与pH的关系如图2所示。已知此温度下,Ca(H2AsO4)2溶于水,Ksp(FeAsO4)=5.7×10-21,Ksp[Ca3(AsO4)2] =6.8×10-19,Ksp(CaHAsO4)=8.4×10-4,。
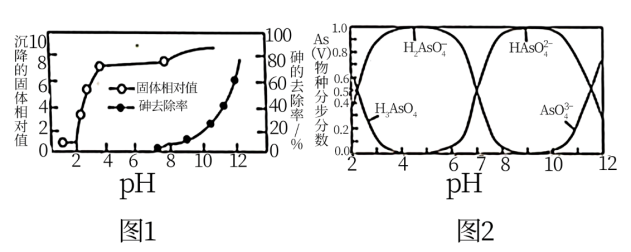
①一级沉降时,当pH=2,废水中开始产生沉淀,该沉淀主要成分的化学式为___________ 。pH调节到8时,开始产生Ca3(AsO4)2沉淀,原因是___________ 。
②二级沉降中,保持溶液pH在8-10之间。加入PFS(聚合硫酸铁,[(Fe2(OH)2n(SO4)3-n]m)形成的Fe(OH)3胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为___________ 。
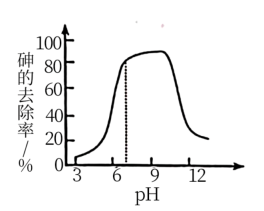
(2)氧化吸附法:新生态MnO2悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(V),也具有较强的吸附性,能吸附水体中的H+而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态MnO2悬浊液对砷去除率如图所示。
①加入新生态MnO2悬浊液使废水中H3AsO3转化为H3AsO4反应的离子方程式为___________ 。
②pH从3增大到7的过程中,随着pH增大,砷的去除率上升。其原因是___________ 。
(3)纳米级零价铁法:纳米级零价铁具有强吸附性和还原性,可直接处理有氧条件下含As(Ⅰ)较多的废水。处理后在纳米级零价铁表面有大量的As(0),外围有大量的As(V)。产生As(0)的原理如图所示。请描述产生As(0)、As(V)的过程:___________ 。
(1)石灰中和-PFS法,处理过程如下:

含砷废水经氧化后,加入石灰乳,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如图1所示。H3AsO3水溶液中含砷微粒的物质的量分布分数与pH的关系如图2所示。已知此温度下,Ca(H2AsO4)2溶于水,Ksp(FeAsO4)=5.7×10-21,Ksp[Ca3(AsO4)2] =6.8×10-19,Ksp(CaHAsO4)=8.4×10-4,。

①一级沉降时,当pH=2,废水中开始产生沉淀,该沉淀主要成分的化学式为
②二级沉降中,保持溶液pH在8-10之间。加入PFS(聚合硫酸铁,[(Fe2(OH)2n(SO4)3-n]m)形成的Fe(OH)3胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为
(2)氧化吸附法:新生态MnO2悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(V),也具有较强的吸附性,能吸附水体中的H+而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态MnO2悬浊液对砷去除率如图所示。

①加入新生态MnO2悬浊液使废水中H3AsO3转化为H3AsO4反应的离子方程式为
②pH从3增大到7的过程中,随着pH增大,砷的去除率上升。其原因是
(3)纳米级零价铁法:纳米级零价铁具有强吸附性和还原性,可直接处理有氧条件下含As(Ⅰ)较多的废水。处理后在纳米级零价铁表面有大量的As(0),外围有大量的As(V)。产生As(0)的原理如图所示。请描述产生As(0)、As(V)的过程:

您最近一年使用:0次
8 . 海洋中蕴含丰富的资源,下图涉及多个以海水为原料的生产流程。
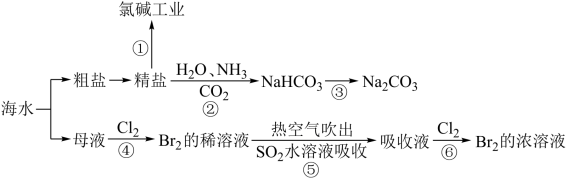
完成下列填空:
(1)步骤①中电解饱和食盐水的化学方程式是_______ 。
(2)工业上用 与
与 (热溶液)制备
(热溶液)制备 ,反应如下:
,反应如下: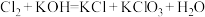 。配平上述反应方程式,并标出电子转移方向和数目
。配平上述反应方程式,并标出电子转移方向和数目_______ 。
(3)关于卤素的下列说法错误的是_______ 。
a.单质的熔点:
b.元素的非金属性: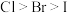
c.单质的氧化性: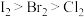
d.从海洋中获得 、
、 的过程均涉及氧化还原反应
的过程均涉及氧化还原反应
(4)对图中所示生产过程的说法正确的是_______
a.溶解度:
b.第④⑤⑥步骤中,溴元素均被还原
c.第⑤⑥步骤的目的是进行溴的富集,提高 的浓度
的浓度
d.联碱法与氨碱法相比, 利用率较高,且能耗低
利用率较高,且能耗低
(5)步骤②是在饱和食盐水中先通入 再通入
再通入 ,原因是
,原因是_______ 。
(6)某同学将 通入
通入 溶液中,当溶液呈中性时,溶液中浓度最大的微粒是
溶液中,当溶液呈中性时,溶液中浓度最大的微粒是_______ 。
a.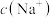 b.
b. c.
c. d.
d.

完成下列填空:
(1)步骤①中电解饱和食盐水的化学方程式是
(2)工业上用
 与
与 (热溶液)制备
(热溶液)制备 ,反应如下:
,反应如下: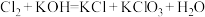 。配平上述反应方程式,并标出电子转移方向和数目
。配平上述反应方程式,并标出电子转移方向和数目(3)关于卤素的下列说法错误的是
a.单质的熔点:

b.元素的非金属性:
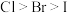
c.单质的氧化性:
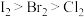
d.从海洋中获得
 、
、 的过程均涉及氧化还原反应
的过程均涉及氧化还原反应(4)对图中所示生产过程的说法正确的是
a.溶解度:

b.第④⑤⑥步骤中,溴元素均被还原
c.第⑤⑥步骤的目的是进行溴的富集,提高
 的浓度
的浓度d.联碱法与氨碱法相比,
 利用率较高,且能耗低
利用率较高,且能耗低(5)步骤②是在饱和食盐水中先通入
 再通入
再通入 ,原因是
,原因是(6)某同学将
 通入
通入 溶液中,当溶液呈中性时,溶液中浓度最大的微粒是
溶液中,当溶液呈中性时,溶液中浓度最大的微粒是a.
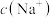 b.
b. c.
c. d.
d.
您最近一年使用:0次
名校
9 . 酸性废水中的砷元素主要以亚砷酸(H3AsO3)形式存在。已知As2S3难溶于水,也不溶于稀硫酸、稀盐酸等无机酸。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为_______ 。
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=_______ 。[Ksp(As2S3)=4.0×10-38]。
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是_______ 。
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为________ (图中“HS·”为自由基,“·”表示孤单电子)。
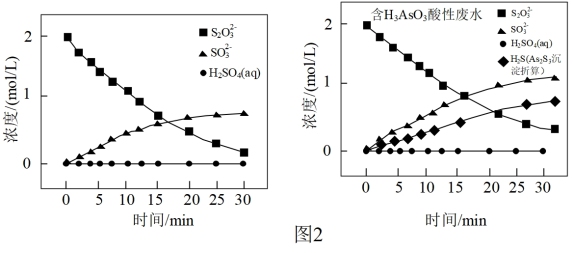
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是_______ 。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O
 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为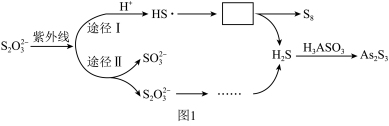
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是

您最近一年使用:0次
2021-03-27更新
|
1496次组卷
|
2卷引用:江苏省南京市盐城市2021届高三第二次模拟考试化学试题
解题方法
10 . 咔咯(corrole)及其配合物作为人工合成的大环配体之一,咔咯的合成及其与金属离子的配位化学备受关注。利用咔咯作为反应配体,可实现过渡金属离子的非常规氧化态,制备功能材料,探索新型催化剂,等等。下图(a)给出三(五氟苯基)咔咯分子(A)的示意图,简写为H3(tpfc)。它与金属离子结合时四个氮原子均参与配位。室温下,空气中,Cr(CO)6和A在甲苯中回流得到深红色晶体B(反应1),B显顺磁性,有效磁矩为1.72μB,其中金属离子的配位几何为四方锥;在惰性气氛保护下,B与三苯基膦(PPh3)和三苯基氧膦(OPPh3)按1:1:1在甲苯中反应得到绿色晶体C(反应2);在氩气保护下,CrCl2和A在吡啶(简写为py)中反应,得到深绿色晶体D(反应3),D中金属离子为八面体配位,配位原子均为氮原子。在一定的条件下,B、C和D之间可以发生转化(下图b),这一过程被认为有可能用于O2的活化或消除。
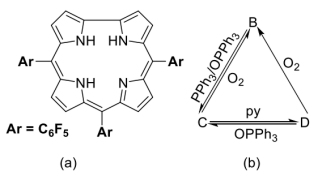
(1)A中的咔咯环是否有芳香性______ ?与之对应的π电子数是______ 。
(2)写出B、C、D的化学式(要求:配体用简写符号表示):
B______ 、C______ 、D______ 。
(3)写出B、C、D中金属离子的价电子组态(均用dn方式表示)。
B______ 、C______ 、D______ 。
(4)写出制备B、C、D的反应方程式(要求:配体用简写符号,系数为最简整数比)。
B______ 、C______ 、D______ 。
(5)利用电化学处理,B可以得电子转化为B-,也可以失去电子转化为B+。与预期的磁性相反,B+依然显示顺磁性。进一步光谱分析发现,与咔咯环配体相关的吸收峰位置发生了显著变化。推测金属离子的价电子组态______ (用dn方式表示),指出磁性与光谱变化的原因______ 。

(1)A中的咔咯环是否有芳香性
(2)写出B、C、D的化学式(要求:配体用简写符号表示):
B
(3)写出B、C、D中金属离子的价电子组态(均用dn方式表示)。
B
(4)写出制备B、C、D的反应方程式(要求:配体用简写符号,系数为最简整数比)。
B
(5)利用电化学处理,B可以得电子转化为B-,也可以失去电子转化为B+。与预期的磁性相反,B+依然显示顺磁性。进一步光谱分析发现,与咔咯环配体相关的吸收峰位置发生了显著变化。推测金属离子的价电子组态
您最近一年使用:0次



