解题方法
1 . 金属钌在电子制造、化学工业及催化剂生产等行业中有关键作用,六氯钌酸铵[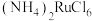 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
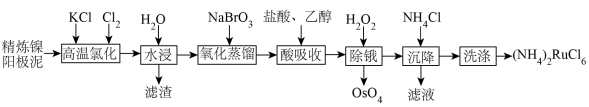
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到 、
、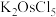 ,
,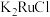 。
。 中Ru元素的化合价为
中Ru元素的化合价为___________ ,生成 的化学方程式为
的化学方程式为___________ 。
(2)“氧化蒸馏”过程中蒸出 、
、 ,生成
,生成 的离子方程式为
的离子方程式为___________ 。
(3)“酸吸收”过程中加入乙醇的作用是___________ 。
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为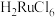 ,溶液中存在
,溶液中存在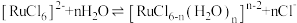
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有___________ 。
(5)检验滤液中主要阴离子的实验方法是___________ ,“洗涤”时最合适的试剂为___________ 。
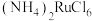 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到
 、
、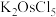 ,
,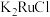 。
。 中Ru元素的化合价为
中Ru元素的化合价为 的化学方程式为
的化学方程式为(2)“氧化蒸馏”过程中蒸出
 、
、 ,生成
,生成 的离子方程式为
的离子方程式为(3)“酸吸收”过程中加入乙醇的作用是
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为
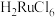 ,溶液中存在
,溶液中存在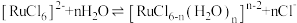
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有(5)检验滤液中主要阴离子的实验方法是
您最近一年使用:0次
名校
解题方法
2 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
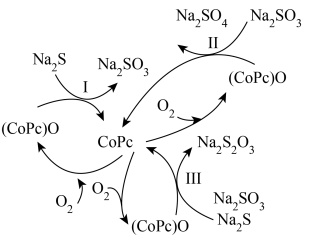
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值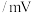 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近一年使用:0次
2023-12-04更新
|
380次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试题
3 . 向 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;② 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是

 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;② 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是
A.还原性: |
B.b点溶液中 |
C.a点时已通入标准状况下氯气的总体积为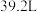 |
D.c点溶液中阴离子的个数为 |
您最近一年使用:0次
2023-12-01更新
|
875次组卷
|
4卷引用:广东省深圳市七校2023-2024学年高一上学期期中联考化学试题
名校
解题方法
4 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
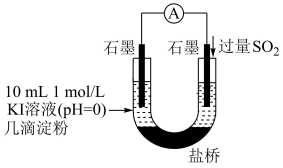
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次
名校
解题方法
5 . 虽然化学反应分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系,回答下列问题:
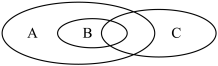
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是______ (填字母)。
(2)配平化学方程式,并用单线桥法标出电子转移方向和数目________ 。
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是_______ (填写化学式)。
(4)配平化学方程式(化学计量数可含x)________ 。
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)配平化学方程式,并用单线桥法标出电子转移方向和数目
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是
(4)配平化学方程式(化学计量数可含x)
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
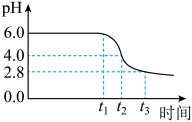
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
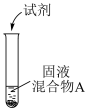
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |
| 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2023-10-31更新
|
316次组卷
|
2卷引用:北京市日坛中学2023-2024学年高三上学期10月检测化学试题
解题方法
7 . 以 固体为原料制备纯
固体为原料制备纯 ,其部分实验过程如下:
,其部分实验过程如下:

已知:① ;
;
② ,
, 有两性,
有两性, ;
;
③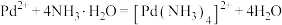 ,
,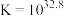 。
。
(1) 为二元强酸,写出“氧化”时发生的主要反应的离子方程式:
为二元强酸,写出“氧化”时发生的主要反应的离子方程式:___________ 。
(2)“氧化”时易产生一种有毒气体,该气体的化学式为___________ 。
(3)若“氧化”不充分,“沉钯”时所得 的产率降低,其原因是
的产率降低,其原因是___________ ;氧化液中Pd的浓度一定,为提高 的产率,“沉钯”时需控制的条件有反应的温度、
的产率,“沉钯”时需控制的条件有反应的温度、___________ 。
(4)CO可将 溶液还原得到金属Pd,写出反应的化学方程式:
溶液还原得到金属Pd,写出反应的化学方程式:___________ 。标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为 ,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:
,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:___________ 。若用 代替CO进行热还原,消耗
代替CO进行热还原,消耗 的质量比理论值略高,其原因是
的质量比理论值略高,其原因是___________ 。
 固体为原料制备纯
固体为原料制备纯 ,其部分实验过程如下:
,其部分实验过程如下:
已知:①
 ;
;②
 ,
, 有两性,
有两性, ;
;③
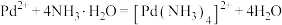 ,
,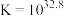 。
。(1)
 为二元强酸,写出“氧化”时发生的主要反应的离子方程式:
为二元强酸,写出“氧化”时发生的主要反应的离子方程式:(2)“氧化”时易产生一种有毒气体,该气体的化学式为
(3)若“氧化”不充分,“沉钯”时所得
 的产率降低,其原因是
的产率降低,其原因是 的产率,“沉钯”时需控制的条件有反应的温度、
的产率,“沉钯”时需控制的条件有反应的温度、(4)CO可将
 溶液还原得到金属Pd,写出反应的化学方程式:
溶液还原得到金属Pd,写出反应的化学方程式: ,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:
,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式: 代替CO进行热还原,消耗
代替CO进行热还原,消耗 的质量比理论值略高,其原因是
的质量比理论值略高,其原因是
您最近一年使用:0次
名校
解题方法
8 . 五氧化二钒用作有机化工的催化剂。从废钒催化剂(主要成分为V2O5、V2O4、K2SO4、SiO2、Fe2O3和Al2O3)中回收V2O5,既避免污染环境又有利于资源综合利用,该工艺流程如下:
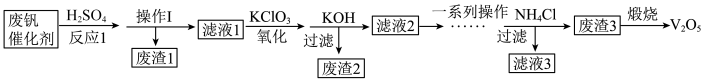
已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和___________ 。
(2)加入KClO3的作用是将VO2+转化为VO ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为___________ 。
(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是___________ 。
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:___________ 。
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,加入氯化铵调节溶液的最佳pH范围为___________ 。

已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和
(2)加入KClO3的作用是将VO2+转化为VO
 ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
您最近一年使用:0次
名校
9 . 镓的化合物
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式_____ 。
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态_____ ,画出C和D的结构_____ 。
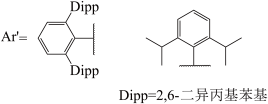
(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式_____ 。
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态

(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式
您最近一年使用:0次
2023-09-07更新
|
285次组卷
|
2卷引用:2023年第37届中国化学奥林匹克(初赛)化学试题
解题方法
10 . 某小组对Cu和 的反应进行相关实验探究。
的反应进行相关实验探究。
【实验探究】实验i:向装有0.5gCu的烧杯中加入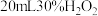 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:___________ 。
【继续探究】针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是___________ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气先慢后快的原因是___________ 。(不考虑温度的影响)。
(3)对比实验i和iii,为探究氨水对Cu的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
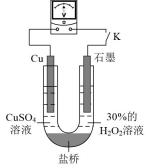
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①解释步骤c中电压增大的原因:___________ 。
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z。则可以得出的结论是:___________ 。
(4)基于以上实验,影响Cu与 反应的因素有
反应的因素有___________ 。(任写一条)
(5)结合上述实验,下列说法正确的是___________ 。
A.电化学是研究物质氧化性、还原性的重要手段之一
B.实验ii中发生的反应中, 只体现氧化性
只体现氧化性
C.在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强
 的反应进行相关实验探究。
的反应进行相关实验探究。【实验探究】实验i:向装有0.5gCu的烧杯中加入
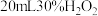 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。(1)写出该反应的化学方程式:
【继续探究】针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
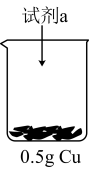 | ii | 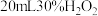 与 与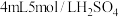 混合液 混合液 | Cu表面产生少量气泡,溶液逐渐变蓝,后产生较多气泡 |
| iii | 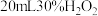 与 与 氨水混合液 氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对Cu的还原性或
 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①解释步骤c中电压增大的原因:
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z。则可以得出的结论是:
(4)基于以上实验,影响Cu与
 反应的因素有
反应的因素有(5)结合上述实验,下列说法正确的是
A.电化学是研究物质氧化性、还原性的重要手段之一
B.实验ii中发生的反应中,
 只体现氧化性
只体现氧化性C.在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强
您最近一年使用:0次