名校
解题方法
1 . 取某铁铝铜合金9.34g,溶于足量的稀硝酸中,金属无剩余,收集到的一种气体是唯一还原产物。向溶液中加过量的氢氧化钠溶液,小心收集沉淀洗涤干净称重11.23g,加热分解至衡重,得固体质量为8.80g。则下列说法不正确的是
| A.参加反应的氢氧化钠不一定比参加反应的硝酸的物质的量多 |
| B.合金中铁铝的物质的量之比为1:2 |
| C.收集到的气体在标准状况下为4.256L |
| D.与铁铝铜合金反应的硝酸的物质的量是0.57mol |
您最近一年使用:0次
解题方法
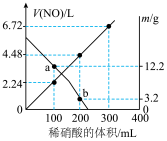
2 . 向 由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成
由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成 的体积
的体积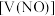 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有 )。下列说法中正确的是
)。下列说法中正确的是
 由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成
由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成 的体积
的体积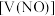 (已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有
(已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有 )。下列说法中正确的是
)。下列说法中正确的是
A.a点时, 稀硝酸中溶解了 稀硝酸中溶解了 粉 粉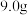 |
B.稀硝酸的浓度为 |
C.加入稀硝酸的体积从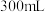 至 至 ,期间收集到 ,期间收集到 的体积约为 的体积约为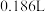 |
D.b点对应的溶液中可能含有的金属阳离子为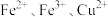 |
您最近一年使用:0次
3 . 金属钨是重要的战略资源,由黑钨矿(主要成分为 、
、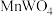 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
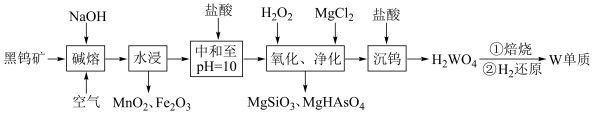
已知:常温下钨酸(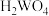 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。
回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第________ 族。 中铁元素的化合价为
中铁元素的化合价为________ 。
(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先________ ,“碱熔”过程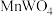 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有 、
、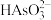 、
、 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)沉钨过程中,判断 是否沉淀完全的方法是
是否沉淀完全的方法是________ 。
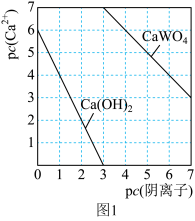
(5)钨酸钙( )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下 和
和 的饱和溶液中,
的饱和溶液中,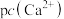 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=________ 。
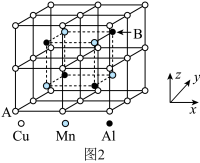
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为________ 。若A原子的坐标参数为(0,0,0),则B原子的坐标参数为________ 。
 、
、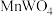 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
已知:常温下钨酸(
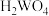 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第
 中铁元素的化合价为
中铁元素的化合价为(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先
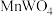 发生反应的化学方程式为
发生反应的化学方程式为(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有
 、
、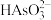 、
、 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为(4)沉钨过程中,判断
 是否沉淀完全的方法是
是否沉淀完全的方法是(5)钨酸钙(
 )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下 和
和 的饱和溶液中,
的饱和溶液中,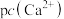 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为

您最近一年使用:0次
4 . 水合肼 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是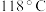 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。

回答下列问题:
(1) 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:___________ 。
(2)已知次氯酸钠与盐酸混合能够生成 ,说明氧化性
,说明氧化性
___________  (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与___________ 有关。
(3) 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为___________ 。
(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是___________ 。
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:___________ 。
(6)电化学方法制备 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。

①双极膜中产生的___________ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②若电路中转移2mol电子,理论上负极区溶液增重___________ g。
 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是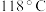 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。
回答下列问题:
(1)
 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:(2)已知次氯酸钠与盐酸混合能够生成
 ,说明氧化性
,说明氧化性
 (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与(3)
 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:
(6)电化学方法制备
 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②若电路中转移2mol电子,理论上负极区溶液增重
您最近一年使用:0次
5 . 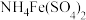 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
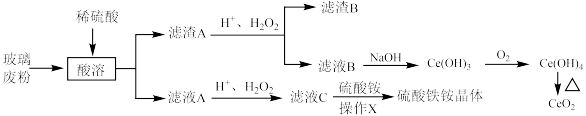
回答下列问题:
(1)“酸溶”中,若使用 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是___________ 。
(2)该生产使用 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是___________ 。
(3)滤渣A转化为滤液B的离子方程式为___________ 。
(4)某同学检验滤液C中是否含有 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论___________ (填“正确”或“错误”),用离子方程式说明:___________ 。
(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有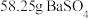 ,每次用
,每次用 的
的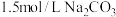 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少___________ 次(假设清洗过程中 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;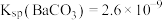 )
)
(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作 为
为___________ 。浓度均为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为___________ 。
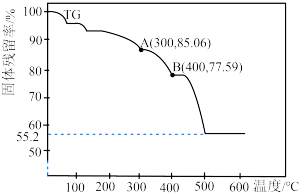
(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率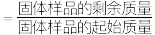
 。
。
写出 的化学方程式:
的化学方程式:___________ 。
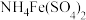 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)“酸溶”中,若使用
 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是(2)该生产使用
 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是(3)滤渣A转化为滤液B的离子方程式为
(4)某同学检验滤液C中是否含有
 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有
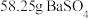 ,每次用
,每次用 的
的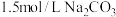 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;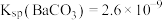 )
)(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作
 为
为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知
 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率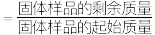
 。
。
写出
 的化学方程式:
的化学方程式:
您最近一年使用:0次
6 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下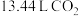 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: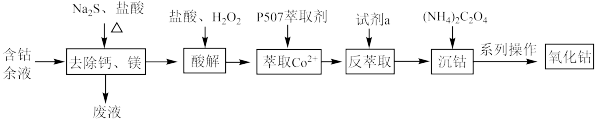
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
名校
7 . 1986年,化学家用化学法制氟,其原理如下:
① (未配平);
(未配平);
② ;
;
③ 。
。
下列说法正确的是
①
 (未配平);
(未配平);②
 ;
;③
 。
。下列说法正确的是
| A.①中氧化产物和还原产物的物质的量之比为2∶3 |
B. 能与 能与 溶液发生反应 溶液发生反应 |
C. 因为其具有强酸性而被用于刻蚀玻璃 因为其具有强酸性而被用于刻蚀玻璃 |
D.用上述方法制备1  ,理论上需要消耗30 ,理论上需要消耗30  |
您最近一年使用:0次
2024-03-27更新
|
168次组卷
|
5卷引用:河北省保定市定州市第二中学2023-2024学年高一下学期3月月考化学试题
8 . 连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。
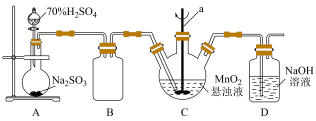
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是_______ 。实验时需要向C中通入稍过量的SO2,目的是________ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为_______ ,判断反应完成的现象是_______ ,待反应结束后经除杂、减压蒸发浓缩、结晶可得产品MnS2O6•nH2O。
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为_______ ;若滴定消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为_______ 。
(5)下列操作会使得测定结果偏大的是_______ 。
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)仪器a的名称为
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为
(5)下列操作会使得测定结果偏大的是
| A.滴定前锥形瓶用蒸馏水洗后未用待测MnSO4溶液润洗 |
| B.滴定前平视读数,滴定结束俯视读数 |
| C.滴定前滴定管中尖嘴处有气泡,滴定后气泡消失 |
| D.对连二硫酸锰产品进行加热操作时加热不充分 |
您最近一年使用:0次
9 . 以炼铁厂锌灰(主要成分为ZnO,含少量的CuO、SiO2、Fe2O3)为原料制备ZnO的流程如图所示。下列说法正确的是
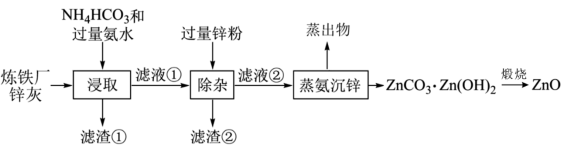
| A.H-N-H键角:[Cu(NH3)4]2+<NH3 |
| B.“滤渣②”的主要成分为Fe、Cu和Zn |
| C.所含金属元素的质量“滤液①”<“滤液②” |
| D.“煅烧”时需要在隔绝空气条件下进行 |
您最近一年使用:0次
10 . 重铬酸钠(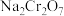 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:

已知: ,
,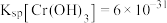
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是________ (填标号)
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式________ 。
(3)为提高铬的“浸出”率,可采取的措施为________ ;浸出液中溶质除 、
、 外,还含有
外,还含有________ (填化学式)。
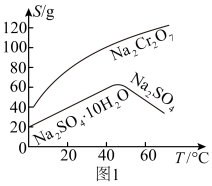
(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是 ,则“操作a”为
,则“操作a”为________ 、________ 、洗涤、干燥。
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
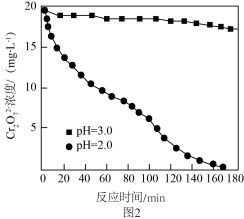
①初始pH为2.0,用铝粉还原 的离子方程式为
的离子方程式为________ 。
②初始pH为3.0,反应180min后,溶液中 浓度仍较高的可能原因是
浓度仍较高的可能原因是________ 。
③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中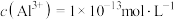 ,则残留的
,则残留的
________  。
。
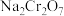 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知:
 ,
,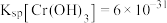
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将
 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式(3)为提高铬的“浸出”率,可采取的措施为
 、
、 外,还含有
外,还含有(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是
 ,则“操作a”为
,则“操作a”为
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有
 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原
 的离子方程式为
的离子方程式为②初始pH为3.0,反应180min后,溶液中
 浓度仍较高的可能原因是
浓度仍较高的可能原因是③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中
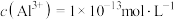 ,则残留的
,则残留的
 。
。
您最近一年使用:0次



