名校
1 . 酸性环境中,纳米Fe/Ni去除NO 过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法
过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法不正确 的是
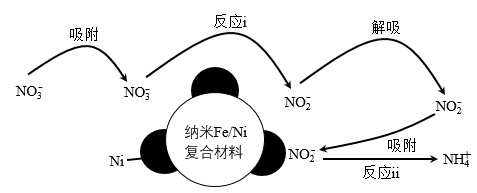
 过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法
过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法
A.反应ⅱ的离子方程式为:NO +3Fe+8H+=NH +3Fe+8H+=NH +3Fe2++2H2O +3Fe2++2H2O |
B.增大单位体积水体中纳米Fe/Ni的投入量,可提高NO 的去除效果 的去除效果 |
| C.假设反应过程都能彻底进行,反应ⅰ、ⅱ消耗的铁的物质的量之比为3:1 |
D.a mol NO 完全转化为NH 完全转化为NH 至少需要4a mol的铁 至少需要4a mol的铁 |
您最近一年使用:0次
2022-01-11更新
|
2125次组卷
|
9卷引用:湖南省娄底市双峰县第一中学2023届高三下学期第五次月考化学试题
湖南省娄底市双峰县第一中学2023届高三下学期第五次月考化学试题湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题北京市中央民族大学附属中学2021-2022学年高三下学期2月适应性练习化学试题湖北省天门中学、仙桃中学2021-2022学年高一下学期2月联考化学试题湖南省长沙市雅礼中学2021-2022学年高三下学期月考(七)化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题江西省南昌市第二中学2022-2023学年高三上学期第三次考试化学试题河南省汝州市第一高级中学2022-2023学年高二上学期11月月考化学试题(已下线)二轮专题强化练 专题8 常见无机物性质的转化
名校
2 . 高铁酸钾(K2FeO4)是一种新型高效消毒净水剂。高铁酸钾的一种实验室制法如下。(装置如图所示,夹持装置略去)

Ⅰ.组装好仪器,检查装置气密性,装入药品。
Ⅱ.打开止水夹K1、K2和甲中分液漏斗活塞,反应一段时间,关闭止水夹K1。
Ⅲ.开启磁力搅拌器,缓慢加入100mL0.8mol•L-1Fe(NO3)3溶液,充分反应。
Ⅳ.反应结束,通入N2一段时间,取下三颈烧瓶,在低温下加入KOH固体至溶液饱和,析出粗产品,过滤。
Ⅴ.将粗产品溶于冷的稀KOH溶液,过滤除杂,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,过滤,用乙醚洗涤。
Ⅵ.重复操作Ⅴ,在真空干燥箱中干燥,得到9.9g产品。
回答下列问题:
(1)仪器a的名称是___ ,a中所盛装的药品是___ (选填字母序号)。
A.NaCl B.MnO2 C.Na2CO3 D.KMnO4
(2)步骤Ⅰ,检查甲装置气密性的方法是___ 。
(3)乙装置中饱和NaCl溶液的作用是___ 。
(4)步骤Ⅱ,丙中三颈烧瓶内发生反应的离子方程式是___ 。
(5)步骤Ⅲ,丙中生成Na2FeO4的离子方程式是___ 。
(6)步骤Ⅳ中通入N2的目的是___ 。步骤Ⅴ,将粗产品“过滤除杂”,主要目的是除去___ (填化学式)。
(7)该实验中产品的产率为___ 。

Ⅰ.组装好仪器,检查装置气密性,装入药品。
Ⅱ.打开止水夹K1、K2和甲中分液漏斗活塞,反应一段时间,关闭止水夹K1。
Ⅲ.开启磁力搅拌器,缓慢加入100mL0.8mol•L-1Fe(NO3)3溶液,充分反应。
Ⅳ.反应结束,通入N2一段时间,取下三颈烧瓶,在低温下加入KOH固体至溶液饱和,析出粗产品,过滤。
Ⅴ.将粗产品溶于冷的稀KOH溶液,过滤除杂,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,过滤,用乙醚洗涤。
Ⅵ.重复操作Ⅴ,在真空干燥箱中干燥,得到9.9g产品。
回答下列问题:
(1)仪器a的名称是
A.NaCl B.MnO2 C.Na2CO3 D.KMnO4
(2)步骤Ⅰ,检查甲装置气密性的方法是
(3)乙装置中饱和NaCl溶液的作用是
(4)步骤Ⅱ,丙中三颈烧瓶内发生反应的离子方程式是
(5)步骤Ⅲ,丙中生成Na2FeO4的离子方程式是
(6)步骤Ⅳ中通入N2的目的是
(7)该实验中产品的产率为
您最近一年使用:0次
2021-11-25更新
|
696次组卷
|
5卷引用:湖南省娄底市第一中学2022-2023学年高三下学期开学摸底考试化学试题
湖南省娄底市第一中学2022-2023学年高三下学期开学摸底考试化学试题四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】16(已下线)一轮巩固卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月月考化学试题
名校
3 . 四氧化三锰(Mn3O4)被广泛应用在磁芯、磁盘、磁带、低温热敏电阻等生产制造中。一种以氧化锰矿为原料(含Mn2O3、MnOOH、Fe2O3、Al2O3、SiO2及CuO等)经还原浸出后用空气氧化法制备四氧化三锰的工艺步骤如下图所示。

回答下列问题:
(1)“浸出”中Mn2O3参与反应的离子方程式为___________ 。
(2)加入适量Mn(OH)2调节pH的目的是___________ 。
(3)“滤渣3”的主要成分有___________ 。
(4)“滤液”溶质的主要成分是___________ ;过滤出的Mn(OH)2需要洗涤,简要说明洗涤沉淀的操作___________ 。
(5)“氧化”时,将固体加入水中,加热,通空气氧化,将固体全部转化为Mn3O4.Mn(OH)2生成Mn3O4的化学方程式为___________ ;

回答下列问题:
(1)“浸出”中Mn2O3参与反应的离子方程式为
(2)加入适量Mn(OH)2调节pH的目的是
(3)“滤渣3”的主要成分有
(4)“滤液”溶质的主要成分是
(5)“氧化”时,将固体加入水中,加热,通空气氧化,将固体全部转化为Mn3O4.Mn(OH)2生成Mn3O4的化学方程式为
您最近一年使用:0次
2021-11-05更新
|
132次组卷
|
2卷引用:湖南省娄底涟源市第一中学2022届高三下学期四月月考化学试题
4 . 炼锌工艺产生大量废泥,主要含有金属锌、铜、镉(Cd),还有少量铁和微量砷。废泥资源化工艺如下:
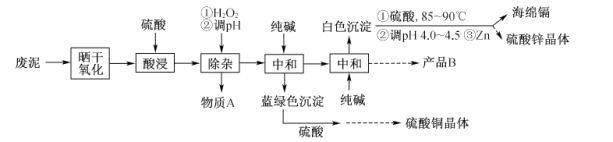
(1)废泥“晒干氧化”主要是把金属转化为盐,有关该盐下列说法正确的是___________(填编号)
(2)“除杂”过程中,发生的离子方程式是___________ ,H2O2需要分批加入,主要目的是___________ 。
(3)两次“中和”后,经过浓缩降温结晶等一系列物理过程,产品B为___________ 。
(4)加入Zn,得到的还原产物是___________ 。
(5)废泥资源化工艺得到4种产品,这样设计的目的是___________(填编号)。

(1)废泥“晒干氧化”主要是把金属转化为盐,有关该盐下列说法正确的是___________(填编号)
| A.硫酸盐 | B.碱式碳酸盐 | C.盐酸盐 | D.亚硫酸盐 |
(3)两次“中和”后,经过浓缩降温结晶等一系列物理过程,产品B为
(4)加入Zn,得到的还原产物是
(5)废泥资源化工艺得到4种产品,这样设计的目的是___________(填编号)。
| A.降低成本,提高效益 |
| B.充分利用废泥,使废泥资源化 |
| C.整个工艺原子利用率达到100% |
| D.增加反应速率,提高反应程度 |
您最近一年使用:0次
2021-10-24更新
|
189次组卷
|
3卷引用:湖南省娄底市新化县第一中学2023届高三第七次月考化学试题
名校
解题方法
5 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2,上述反应配平后 FeO·Cr2O3与 NaNO3的系数比为
Na2CrO4+Fe2O3+CO2+NaNO2,上述反应配平后 FeO·Cr2O3与 NaNO3的系数比为___________ 。
(2)滤渣 1 中含量最多的金属元素是___________ ,滤渣 2 的主要成分是___________ 及含硅杂质。
(3)步骤④调滤液 2 的 pH 使之变___________ (填“大”或“小”),原因是___________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。

向“滤液 3”中加入适量 KCl,蒸发浓缩,冷却结晶,过滤得到 K2Cr2O7固体。冷却到___________ (填标号)得到的 K2Cr2O7固体产品最多。
a.80 ℃ b.60 ℃ c.40 ℃ d.10 ℃
步骤⑤的反应类型是___________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2,上述反应配平后 FeO·Cr2O3与 NaNO3的系数比为
Na2CrO4+Fe2O3+CO2+NaNO2,上述反应配平后 FeO·Cr2O3与 NaNO3的系数比为(2)滤渣 1 中含量最多的金属元素是
(3)步骤④调滤液 2 的 pH 使之变
(4)有关物质的溶解度如图所示。

向“滤液 3”中加入适量 KCl,蒸发浓缩,冷却结晶,过滤得到 K2Cr2O7固体。冷却到
a.80 ℃ b.60 ℃ c.40 ℃ d.10 ℃
步骤⑤的反应类型是
您最近一年使用:0次
2021-10-19更新
|
364次组卷
|
3卷引用:湖南省娄底市双峰县第一中学2023届高三第七次月考化学试题
湖南省娄底市双峰县第一中学2023届高三第七次月考化学试题山东省鄄城县实验中学2021-2022学年高三上学期第一次月考化学试卷题(已下线)专题06 钛铬锰元素拓展之工业流程大题-【微专题·大素养】备战2022年高考化学核心突破(元素拓展综合题)
名校
6 . 氯化钯可以催化乙烯制备乙醛(Wacker法),反应过程如图。下列叙述错误的是
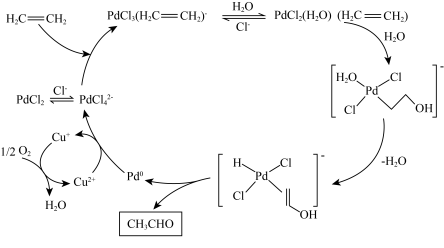

A.CuCl被氧化的反应为2CuCl+2HCl+ O2=2CuCl2+H2O O2=2CuCl2+H2O |
| B.如果原料为丙烯,则产物可能是丙酮 |
C.制备乙醛的总反应为CH2=CH2+ O2 O2 CH3CHO CH3CHO |
D.该反应的催化剂是PbCl |
您最近一年使用:0次
2021-05-20更新
|
795次组卷
|
4卷引用:湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题湖北省武汉市蔡甸区汉阳一中2021届高三下学期二模化学试题(已下线)考点01 物质的组成、分类及转化-备战2022年高考化学学霸纠错(全国通用)湖南省郴州市桂阳县第一中学 2021-2022 学年高三下学期期中考试试题
名校
7 . 工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:

(1)上述物质中为红棕色气体的是___________ (填化学式);
(2)NH3溶于水所得溶液呈___________ (填“酸性”、“碱性”或“中性”);
(3)配平NO2→HNO3的化学方程式:3NO2+H2O=___________HNO3+NO。___________
(4)已知I2与H2.发生反应:I2(g)+H2(g) 2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。
2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。
①用I2表示该反应的化学反应速率是___________ mol·L-1·min-1;
②当其他条件不变时,升高温度,该反应速率将___________ (填“增大”或“减小”)。

(1)上述物质中为红棕色气体的是
(2)NH3溶于水所得溶液呈
(3)配平NO2→HNO3的化学方程式:3NO2+H2O=___________HNO3+NO。
(4)已知I2与H2.发生反应:I2(g)+H2(g)
 2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。
2HI(g)。一定条件下,将1molI2和1molH2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。①用I2表示该反应的化学反应速率是
②当其他条件不变时,升高温度,该反应速率将
您最近一年使用:0次
8 . 工业用强氧化剂 PbO2来制备 KClO4的工业流程如图:
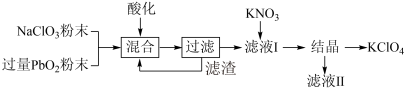
下列判断不正确的是

下列判断不正确的是
| A.“滤渣”的主要成分是 PbO2,可循环使用 |
| B.“酸化”的试剂可用浓盐酸 |
| C.NaClO3与 PbO2反应的物质的量之比为1:1 |
| D.在滤液1中加入 KNO3制得 KClO4利用的是体系中各物质溶解度不同 |
您最近一年使用:0次
2021-03-19更新
|
676次组卷
|
4卷引用:湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题
湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题山东省德州市2021届高三下学期高考第一次模拟考试化学试题(已下线)第06讲 氧化还原反应(精练)-2022年高考化学一轮复习讲练测(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】
名校
解题方法
9 . 一种从废电池正极材料(含铝箔、 、
、 及少量不溶于酸碱的导电剂)中回收各种金属的工艺流程如下:
及少量不溶于酸碱的导电剂)中回收各种金属的工艺流程如下:
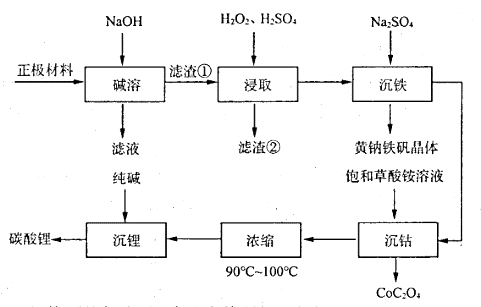
已知:①黄钠铁矾晶体颗粒粗大,沉淀速度快,易于过滤。
②钴酸锂难溶于水,碳酸锂的溶解度随温度升高而降低。
③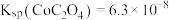 ,
,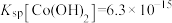 。
。
回答下列问题:
(1)为了提高“碱溶”效率,可以采取的措施是_______ (写出一条即可)。
(2)“浸取”时有无色气体产生,发生反应的离子方程式为_______ 。
(3)“沉钴”时采用饱和草酸铵溶液将钴元素转化为 ,与草酸钠溶液相比效果更好,原因是
,与草酸钠溶液相比效果更好,原因是_______ 。
(4)“沉锂”后得到碳酸锂固体的实验操作为_______ 。
(5)“沉铁”时所得黄钠铁矾的化学式可表示为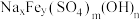 。采用滴定法测定黄钠铁矾样品的组成,实验步骤如下:
。采用滴定法测定黄钠铁矾样品的组成,实验步骤如下:
Ⅰ.称取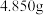 样品,加盐酸完全溶解后,配成
样品,加盐酸完全溶解后,配成 溶液。
溶液。
Ⅱ.量取 溶液,加入足量的KI,用
溶液,加入足量的KI,用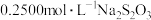 溶液进行滴定至终点
溶液进行滴定至终点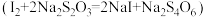 ,消耗
,消耗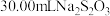 溶液。
溶液。
Ⅲ.另取 溶液,加入足量
溶液,加入足量 溶液,充分反应后过滤、洗涤、干燥,得到沉淀
溶液,充分反应后过滤、洗涤、干燥,得到沉淀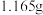 。
。
用 溶液进行滴定时,使用的指示剂为
溶液进行滴定时,使用的指示剂为_______ ;黄钠铁矾的化学式为_______ 。
 、
、 及少量不溶于酸碱的导电剂)中回收各种金属的工艺流程如下:
及少量不溶于酸碱的导电剂)中回收各种金属的工艺流程如下:
已知:①黄钠铁矾晶体颗粒粗大,沉淀速度快,易于过滤。
②钴酸锂难溶于水,碳酸锂的溶解度随温度升高而降低。
③
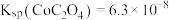 ,
,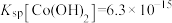 。
。回答下列问题:
(1)为了提高“碱溶”效率,可以采取的措施是
(2)“浸取”时有无色气体产生,发生反应的离子方程式为
(3)“沉钴”时采用饱和草酸铵溶液将钴元素转化为
 ,与草酸钠溶液相比效果更好,原因是
,与草酸钠溶液相比效果更好,原因是(4)“沉锂”后得到碳酸锂固体的实验操作为
(5)“沉铁”时所得黄钠铁矾的化学式可表示为
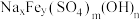 。采用滴定法测定黄钠铁矾样品的组成,实验步骤如下:
。采用滴定法测定黄钠铁矾样品的组成,实验步骤如下:Ⅰ.称取
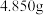 样品,加盐酸完全溶解后,配成
样品,加盐酸完全溶解后,配成 溶液。
溶液。Ⅱ.量取
 溶液,加入足量的KI,用
溶液,加入足量的KI,用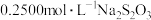 溶液进行滴定至终点
溶液进行滴定至终点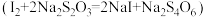 ,消耗
,消耗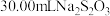 溶液。
溶液。Ⅲ.另取
 溶液,加入足量
溶液,加入足量 溶液,充分反应后过滤、洗涤、干燥,得到沉淀
溶液,充分反应后过滤、洗涤、干燥,得到沉淀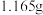 。
。用
 溶液进行滴定时,使用的指示剂为
溶液进行滴定时,使用的指示剂为
您最近一年使用:0次
2021-01-27更新
|
445次组卷
|
3卷引用:湖南省娄底市第五中学2022届高三下学期5月月考化学试题
解题方法
10 . (1)写出下列物质在水溶液中的电离方程式:
①KOH:_______________________________________________ ;
②KHSO4:____________________________________________ ;
③Fe2(SO4)3:__________________________________________ ;
(2)写出下列反应的离子方程式:
④Ba(OH)2溶液和H2SO4溶液反应________________________________________ ;
⑤Na2CO3溶液和HNO3溶液反应_________________________________________ ;
(3)配平下列方程式
⑥ NaClO3+ SO2+ H2SO4= ClO2+ NaHSO4_________________________________________ ;
⑦ Cl-+ MnO + H+= Mn2++ Cl2↑+ H2O
+ H+= Mn2++ Cl2↑+ H2O_________________________________________ 。
①KOH:
②KHSO4:
③Fe2(SO4)3:
(2)写出下列反应的离子方程式:
④Ba(OH)2溶液和H2SO4溶液反应
⑤Na2CO3溶液和HNO3溶液反应
(3)配平下列方程式
⑥ NaClO3+ SO2+ H2SO4= ClO2+ NaHSO4
⑦ Cl-+ MnO
 + H+= Mn2++ Cl2↑+ H2O
+ H+= Mn2++ Cl2↑+ H2O
您最近一年使用:0次



