1 . 元素周期表是指导我们系统学习化学的重要工具。(答案都填写化学式)
(1)如图是铁元素在元素周期表中的有关信息。

写出Fe的原子结构示意图__ ,自然界中存在的54Fe和56Fe,它们互称为___ 。将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是__ 。通常证明某溶液中含Fe2+的化学方法是___ 。
下表是元素周期表的一部分:

(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的__ 相同。处于同一列的N和P位于元素周期表的__ 族。
(3)通过元素周期表,我们可以知道:
①氮元素的最低化合价为_ ,其气态氢化物的结构式为__ 。
②与硅元素处于同一周期,两性金属元素是__ ,并写出其在元素周期表中的位置:第__ 周期,__ 族,该元素的最高价氧化物对应水化物的电离方程式为__ 。
③第三周期半径最大的金属元素__ ,该元素形成氢氧化物的电子式_ ,检验物质中是否含有该元素的方法是:__ 。
④在上表所列元素的最高价氧化物对应水化物中酸性最强的是__ (写化学式)。该元素与硫元素相比,非金属性较强的元素是__ (填元素符号),请写出证明该结论的一个实验事实:__ 。
⑤如图,将潮湿的Cl2单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是___ 。

a.浓硫酸 b.NaOH溶液 c.KI溶液 d.饱和食盐水
⑥由于氢元素的化合价,有人提议还可以将其放在第__ 族,又有人提议可将它放在周期表中第IVA族,这样建议的原因是__ 。
⑦科学家通过对某些元素的化合价进行研究,寻找高效农药。这些元素往往位于元素周期表的__ (选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
(1)如图是铁元素在元素周期表中的有关信息。

写出Fe的原子结构示意图
下表是元素周期表的一部分:

(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的
(3)通过元素周期表,我们可以知道:
①氮元素的最低化合价为
②与硅元素处于同一周期,两性金属元素是
③第三周期半径最大的金属元素
④在上表所列元素的最高价氧化物对应水化物中酸性最强的是
⑤如图,将潮湿的Cl2单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是

a.浓硫酸 b.NaOH溶液 c.KI溶液 d.饱和食盐水
⑥由于氢元素的化合价,有人提议还可以将其放在第
⑦科学家通过对某些元素的化合价进行研究,寻找高效农药。这些元素往往位于元素周期表的
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
您最近一年使用:0次
2 . 将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为__________ ,若将钠块放到石棉网上加热会生成______ 色固体,该反应的化学方程式为_______ ,该固体遇水会有无色无味的气体生成,该反应的化学方程式为___________ ,将氯气通入反应后的溶液中,发生反应的化学方程式为_________ 。
您最近一年使用:0次
名校
3 . 在高锰酸钾固体上滴加浓盐酸,马上产生黄绿色气体。反应的化学方程式为:2KMnO4 + 16HCl=2KC1 + 2MnCl2 + 5C12↑+ 8H2O
回答下列问题:
(1)此反应中的氧化剂是____ ,当在标准状况下产生0.112L氯气,转移的电子数为____ mol。
(2)氯原子的核电荷数为______ ;氧原子的原子结构示意图_______ 。
(3)在KC1固体中存在的化学键是__________ ;写出H2O电子式_________ 。
(4)工业上用氯气与消石灰作原料制造漂粉精,此反应的化学方程式是_________ 。
(5)浓盐酸的溶质是氯化氢,用一个实验证明氯化氢极易溶于水。_________ 。
回答下列问题:
(1)此反应中的氧化剂是
(2)氯原子的核电荷数为
(3)在KC1固体中存在的化学键是
(4)工业上用氯气与消石灰作原料制造漂粉精,此反应的化学方程式是
(5)浓盐酸的溶质是氯化氢,用一个实验证明氯化氢极易溶于水。
您最近一年使用:0次
4 . 钠、铁、镁等元素在生产生活中有广泛的用途,完成下列填空:
Ⅰ钠的重要化合物
(1)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯气需要0.56g硫代硫酸钠,反应的离子方程式为______ 。
(2)除去Al2O3中混有的Fe2O3,可将混合物溶于过量的盐酸,再加入Na2CO3调节pH使Fe3+沉淀完全而Al3+不沉淀,用化学用语及相应的离子方程式解释加入Na2CO3的目的______ 。
Ⅱ铁的重要化合物
(3)磷酸铁(FePO4•2H2O是难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
①称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是______ 。
②向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、______ 和______ 。
③将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为______ 。
Ⅲ镁的重要化合物
(4)氧化镁和碳粉与氯气在一定条件下反应可制备氯化镁,若尾气可用足量的氢氧化钠溶液完全吸收,则生成的盐为______ 。
Ⅰ钠的重要化合物
(1)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯气需要0.56g硫代硫酸钠,反应的离子方程式为
(2)除去Al2O3中混有的Fe2O3,可将混合物溶于过量的盐酸,再加入Na2CO3调节pH使Fe3+沉淀完全而Al3+不沉淀,用化学用语及相应的离子方程式解释加入Na2CO3的目的
Ⅱ铁的重要化合物
(3)磷酸铁(FePO4•2H2O是难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
①称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是
②向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、
③将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为
Ⅲ镁的重要化合物
(4)氧化镁和碳粉与氯气在一定条件下反应可制备氯化镁,若尾气可用足量的氢氧化钠溶液完全吸收,则生成的盐为
您最近一年使用:0次
5 . 含氯消毒剂在生产生活中有着广泛的用途。完成下列填空:
(1)工业上将氯气溶于一定浓度的氢氧化钠溶于可制得“84消毒液”,反应的离子方程式为_________ 。
(2)“84消毒液”(主要成分是NaClO)不能和洁厕剂(主要成分是浓盐酸)混用。混用时反应的化学方程式是_______________________________ ;“84消毒液”不能对钢铁制品进行消毒,原因是____________ 。
(3)工业常用石灰乳和氯气反应制取漂粉精,其主要设备是氯化塔,将含有3%-6%水分的石灰乳从塔顶部喷洒而入,氯气从塔的最底层通入。这样加料的目的是__________ ;处理从氯化塔中逸出气体的方法是_____ 。
(4)二氧化氯(ClO2)是一种黄绿色易溶于水的气体。工业上常用NaClO3和Na2SO3溶液混合并加入H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为_________ 。
(5)在用二氧化氯进行水处理时,ClO2除了杀菌消毒外,还能除去水中的Fe2+和Mn2+。用ClO2氧化除去Mn2+生成ClO2-和MnO2的离子方程式为___________________________ 。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶于可制得“84消毒液”,反应的离子方程式为
(2)“84消毒液”(主要成分是NaClO)不能和洁厕剂(主要成分是浓盐酸)混用。混用时反应的化学方程式是
(3)工业常用石灰乳和氯气反应制取漂粉精,其主要设备是氯化塔,将含有3%-6%水分的石灰乳从塔顶部喷洒而入,氯气从塔的最底层通入。这样加料的目的是
(4)二氧化氯(ClO2)是一种黄绿色易溶于水的气体。工业上常用NaClO3和Na2SO3溶液混合并加入H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为
(5)在用二氧化氯进行水处理时,ClO2除了杀菌消毒外,还能除去水中的Fe2+和Mn2+。用ClO2氧化除去Mn2+生成ClO2-和MnO2的离子方程式为
您最近一年使用:0次
名校
6 . 2004年4月15日,重庆某化工厂氯气泄漏并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为___________________________________ ;形成烟的成分包含Cl2与Fe反应的产物___________ ,Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式__________________________________ 。
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:________________________________ 。
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该反应中氧化剂是_______ ,还原剂是_______ ,氧化剂与还原剂的物质的量之比为_________ ;若生成1mol ClO2则转移电子数为____________ (NA表示阿伏伽德罗常数)。
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该反应中氧化剂是
您最近一年使用:0次
7 . 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下(氯化过程中少量Ca(ClO)2分解为CaCl2和O2):
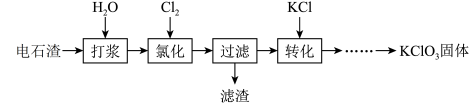
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①生成Ca(ClO)2的化学方程式为__________________________________________________ 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________ (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。请回答:
①滤渣的主要成分为__________ (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] :n[CaCl2]________ 1∶5(填“>”、“<”或“=”)。

(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①生成Ca(ClO)2的化学方程式为
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。请回答:
①滤渣的主要成分为
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] :n[CaCl2]
您最近一年使用:0次
名校
8 . (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ______________ 。
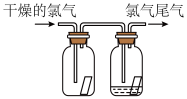
(2)为防止氯气尾气污染空气,可用________ 溶液吸收多余的氯气,原理是(用化学方程式表示)____________________ 。
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______ (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______ (用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO

(2)为防止氯气尾气污染空气,可用
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
A.O2 B.Cl2 C.CO2 D.HClO
您最近一年使用:0次
2019-02-26更新
|
247次组卷
|
5卷引用:2015-2016学年安徽省阜阳市太和八中高一上学期期末文化学试卷
2015-2016学年安徽省阜阳市太和八中高一上学期期末文化学试卷吉林省长春外国语学校2017-2018学年高一上学期期末考试(理)化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题福建省永安市第三中学2019-2020学年高一10月月考化学试题(已下线)第02讲 氯气-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)
11-12高一上·湖北·期末
解题方法
9 . 完成下列问题
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______ 。

(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_______ 溶液吸收多余的氯气,原理是(用化学方程式表示)_______ 。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______ (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______ (用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(4)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故,造成多人在事故中失踪、死伤,数十万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______(用字母代号填)。
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是

(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
A.O2 B.Cl2 C.CO2 D.HClO
(4)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故,造成多人在事故中失踪、死伤,数十万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______(用字母代号填)。
| A.NaOH | B.NaCl | C.KBr | D.Na2CO3 |
您最近一年使用:0次
解题方法
10 . 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。
【I】日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献。请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是___________。
(2)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是

(3)航天技术上使用的氢一氧燃料电池具有高能、轻便和不污染环境等优点。氢一氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为2H2+O2=2H2O。酸式氢一氧燃料电池的电解质是酸,放电时其正极的电极反应可表示为__________________ ,放电一段时间后电解质溶液的pH将_____ (填“变大”、“变小”、“不变”)。
【II】自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(4)漂白粉是常用的一种消毒剂,保存不当容易变质,有关化学方程式为____________ 。漂白粉不能与家庭中常用的洁厕剂(一种酸性液体,主要含HCl)混合使用,否则容易造成人体中毒,其原因是(用有关的离子方程式表示)____________________ 。
(5)高铁酸钾(K2FeO4)足一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应的可用离子方程式表示为___________ 。
(6)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是______________ 。
【I】日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献。请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是___________。
| A.锌锰干电池工作一段时间后碳棒变细 | B.氢氧燃料电池可将热能直接转变为电能 |
| C.甲烷燃料电池工作时甲烷在负极被氧化 | D.太阳能电池的主要材料是高纯度的二氧化硅 |

| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO42-)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡 |
【II】自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(4)漂白粉是常用的一种消毒剂,保存不当容易变质,有关化学方程式为
(5)高铁酸钾(K2FeO4)足一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应的可用离子方程式表示为
(6)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是
您最近一年使用:0次



